Riassunto
Nella Foresta del Cansiglio la vegetazione tipica è il Dentario pentaphylli-Fagetum sylvaticae; al suo interno ci sono 2 tipi di praterie di origine secondaria: quelle caratterizzate da Deschampsia cespitosa e quelle da Festuca rubra. In alcune di esse l’azione antropica è stata così forte da ottenere degli “erbai” ossia praterie con forte resa in foraggio. Nelle praterie a Deschampsia cespitosa, a seconda delle condizioni ecologiche, si possono riconoscere 5 subassociazioni diverse tra loro. Questo studio, di chiara impronta ecologica e il primo per l’area del Cansiglio e per i territori limitrofi (per l’Italia settentrionale), studia i rapporti tra la flora micologica e le varie associazioni e subassociazioni prative. Questo lavoro inoltre conclude lo studio dei macromiceti sia delle comunità prative che di quelle delle zone umide della Foresta del Cansiglio. Viene evidenziato come la componente micologica contribuisca in maniera rilevante a incrementare la biodiversità delle associazioni vegetali e che negli “erbai” anche i funghi si adattano alla regola che “all’aumentare della biomassa delle piante vascolari diminuisce la biodiversità”.
Abstract
The mycological flora of the meadow communities in the Consiglio Forest (Veneto, NE Italy)
The typical vegetation in the Cansiglio Forest is the Dentario pentaphylli-Fagetum sylvaticae. Two types of grasslands of secondary origin are present here: those characterized by Deschampsia cespitosa, and those by Festuca rubra. The anthropic action has, in some of these places, resulted in “erbai”, that consist in grasslands with a strong yield in forage. Five different sub-associations can be recognized in the grasslands with Deschampsia cespitosa, depending on the ecological conditions. This study has a clear ecological nature, and it is the first one conducted not only in the Cansiglio area, but also in the northern Italy. The research investigates the relationship between the mycological flora and the various associations, and subassociations, of meadowlands. This work also completes the study of the macromycetes in both the meadowland communities and in the wetlands of the Cansiglio Forest. The results showed that the mycological component is fundamental for increasing the biodiversity of plant associations. Moreover, data demonstrated that “in erbai” even fungi adapt to the rule: “as biomass of vascular plants increases, biodiversity decreases”.
Introduzione
La Foresta del Cansiglio è un sito di grande pregio naturalistico e, come SIC-ZPS, fa parte di Rete Natura 2000 (Direttiva n°92/43/CEE). Al suo interno c’è una grande complessità che deriva dalla sua posizione geografica, dalle caratteristiche geomorfologiche (è un ampio catino, un polje, con numerose doline e inghiottitoi) e climatiche e anche da una lunga azione antropica. Il Cansiglio è la porzione più occidentale delle Prealpi Venete-Friulane, fa parte del massiccio del Cansiglio- Cavallo (Cancian et al., 1985) e ha una altitudine media di 1189 m s.l.m. (Natura 2000, Formulario standard). I suoli presenti nelle zone prative sono piuttosto evoluti e profondi del tipo Cutanic Alisol & Luvic Phaeozems; i primi hanno un pH acido, i secondi sono invece vicini alla neutralità. Questi suoli si sviluppano per lo più su calcari marnosi (scaglia grigia e scaglia rossa) di età cretacica, su cui è attivo il fenomeno carsico (Garlato e Borsato, 2016). Il macroclima dell’area di studio può essere definito umido montano, con stagione fredda; tutta l’area è inoltre interessata dal fenomeno dell’inversione termica (Borsato, 2016). L’originaria vegetazione, la faggeta del Dentario pentaphylli-Fagetum sylvaticae (Del Favero, 2004), è stata oggetto di gestione da parte dell’uomo fin dai secoli scorsi e questo ha portato alla trasformazione di alcune sue parti in praterie, che perciò sono tutte di origine secondaria. La flora di queste praterie e di quelle limitrofe del Monte Pizzoc sono state oggetto di numerosi studi (Borsato, 2016; Borsato, 2017, Busato & Lorenzoni, 1971; Busato, 1964; De Conti, 2017; De March, 1994; Fiamoi, 1985; Lorenzoni, 1978; Marchiori & Ros, 1978; Pietriboni, 2001; Veneto Agricoltura, 2010), e il primo inquadramento fitosociologico è presente in Borsato 2016. Durante lo studio della componente vegetale dei prati è emersa l’abbondanza e la diffusione della componente micologica. Gli autori hanno condotto la loro ricerca micologica non solo per realizzare la lista floristica delle specie fungine qui presenti, ma hanno voluto dare al loro studio una chiara valenza ecologica, hanno cioè studiato il rapporto esistente tra i funghi e le comunità vegetali che li accolgono, diverso in funzione appunto delle condizioni ecologiche. Vorremmo quindi definire questo approccio di tipo mico-fitosociologico. Viene perciò riconosciuto alle associazioni vegetali il ruolo di entità che accolgono e determinano tutti gli altri tipi di comunità. Per questo motivo il presente studio è il primo conosciuto in Italia e conclude la ricerca micologica riguardante il rapporto tra i funghi e le comunità zonali prative e quelle azonali delle zone umide della Foresta del Cansiglio (Bizio & Borsato, 2016).
Materiali e metodi
Componente vegetale
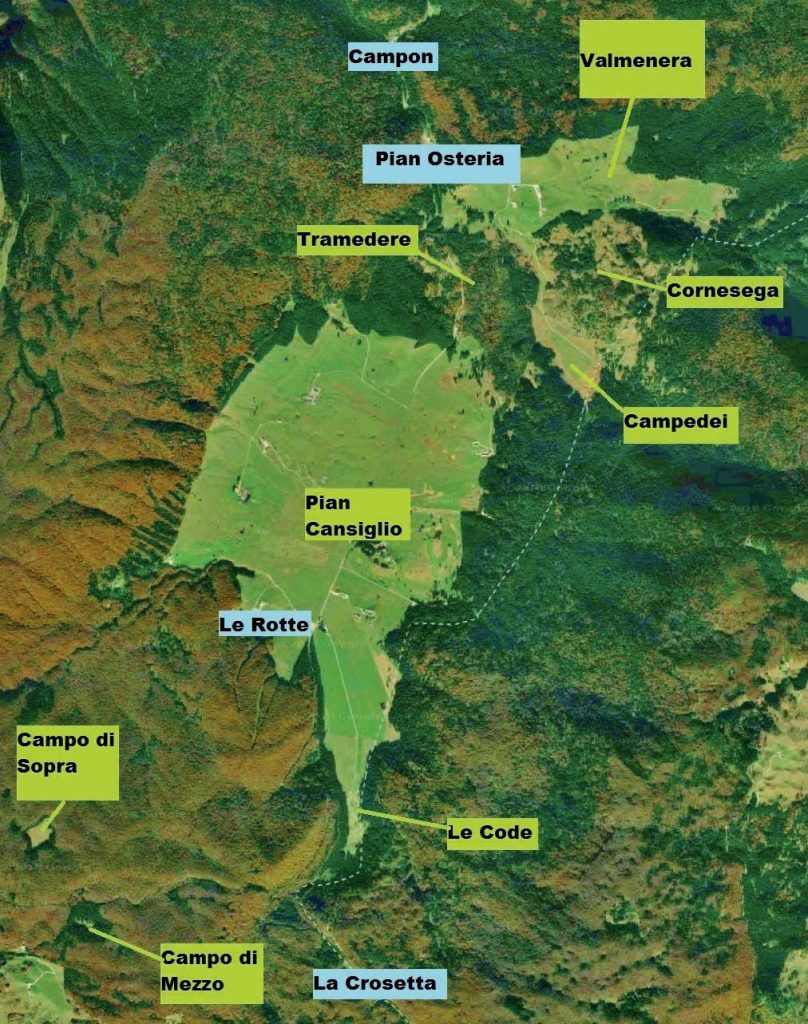
Lo studio della flora vascolare prativa dell’area di studio è stato condotto nel corso di 3 anni (dal 2013 al 2015), invece quello della componente micologica si è protratto dal 2015 al 2017. Le 62 aree di saggio prative esaminate hanno una superficie di circa 100 m2 ciascuna e sono distribuite in Pian Cansiglio, Piana delle Code, Valmenera, Tramedere, Cornesega, Campedei, Campo di Sopra e Campo di Mezzo. I prati presi in considerazione sono stati di vario tipo, in modo da avere i campioni di tutte le tipologie presenti, diverse tra loro in base a: località, altitudine, inclinazione del versante e utilizzo che ne è stato/ viene fatto. Per la determinazione delle specie è stato utilizzato come testo di partenza la “Flora d’Italia” (Pignatti, 1982) integrandolo con altri libri e monografie (Aa.Vv., 1964-1993; Aeschimann et al., 2004; Bačič et al., 2007; Bernini et al., 2002; Eggenberg & Mohl, 2013; Festi, 2000; Fischer et al., 2008; Dalla Fior, 1985; Gottschlich & Pujatti, 2002; Lauber & Wagner, 2001; Oberdorfer, 1994; Poldini et al., 2002; Rothmaler, 1995). Per la nomenclatura definitiva si è seguita “La flora vascolare del Friuli Venezia Giulia” (Poldini et al., 2001).
La vegetazione è stata studiata utilizzando il metodo fitosociologico di Braun- Blanquet; per i coefficienti di ricoprimento è stata usata la scala proposta da Pignatti (1952-1953). Per condurre ordinamenti e classificazioni, i coefficienti di ricoprimento in scala Pignatti sono stati convertiti in scala Van der Maarel. La classificazione dei rilievi è stata effettuata con il programma di analisi multivariata Syntax 2000 (Podani, 2001) applicando gli algoritmi dei legami medio e completo (Anderberg, 1973) sulla matrice di somiglianza calcolata con l’indice Similarity ratio (Wishart, 1969).
L’ordinamento dei rilievi è stato eseguito con l’analisi delle componenti principali (PCA) considerando la matrice di covarianza tra le specie.
In tutto il lavoro si è seguita l’impostazione delle schede contenute in “Plant communities of Italy: the Vegetation Prodrome” (2014). Per quanto riguarda la lista floristica delle specie vegetali si veda Borsato V. (2017).
Componente micologica
Il progetto di indagine micologica si è sviluppato rilevando i corpi fruttiferi di macromiceti presenti in 46 su 62 aree di saggio indagate durante una ventina di sopralluoghi, avvenuti in poco più di due anni, dall’ottobre 2015, al novembre 2017. Tali 46 siti di ricerca sono comunque da considerarsi ampiamente rappresentativi delle diverse comunità vegetazionali presenti nell’area indagata.
I corpi fruttiferi rilevati sono stati fotografati in ambiente con fotocamere digitali Canon EOS 550D e Fujifilm X20 e identificati prevalentemente da freschi sulla base di osservazioni macro e micromorfologiche, organolettiche ed ecologiche. Per i rilievi microscopici è stato utilizzato un microscopio binoculare WILD M11 montante ottiche Leitz-Zeiss. I preparati sono stati montati in acqua distillata, blu cotone (per evidenziare l’eventuale cianofilia e le ornamentazioni sporali negli ascomiceti), blu di cresile (per la verifica della metacromasia), carminio acetico (per fare risaltare le granulazioni siderofile),
floxina (per i tessuti degli ascomiceti), KOH al 5%, reagente di Melzer (per evidenziare l’eventuale amiloidia/destrinoidia), rosso Congo anionico, rosso Congo ammoniacale al 20% (per l’allestimento della maggior parte dei preparati istologici); l’osservazione è avvenuta a 600 e a 1000 ingrandimenti, tramite obiettivo ad immersione.
Alcuni tra i campioni essiccati più significativi (87) sono stati conferiti in MCVE (Erbario Micologico del Museo di Storia Naturale di Venezia) e sono a disposizione degli studiosi interessati; altri sono conservati negli erbari personali degli autori.
Per la nomenclatura si è fatto riferimento al Codice Internazionale di Nomenclatura (C.I.N.) adottato nel Congresso di Melbourne (2012); per l’indicazione delle sinonimie proposte, salvo diverso avviso, si è utilizzato l’Index Fungorum (http://www.indexfungorum.org/). Le abbreviazioni dei nomi degli autori sono tratte da Kirk & Ansell (2003).
Per il riconoscimento delle specie fungine è stata consultata la letteratura specializzata allo studio dei funghi del piano montano, dell’arco alpino, dell’emisfero boreale, del Nord Europa (Knudsen & Vesterholt, 2008), oltre alle più rilevanti opere di carattere monografico di volta in volta citate nel testo.
Risultati
Lo studio della vegetazione dei prati della Foresta del Cansiglio ha evidenziato 3 diverse comunità appartenenti alla classe Molinio-Arrhenatheretea, come riassunto nel seguente “Quadro sintassonomico”:
56 Cl.: MOLINIO-ARRHENATHERETEA Tüxen 1937
56.2 Ord.: Arrhenatheretalia elatioris Tüxen 1931
56.2.3 All.: Triseto flavescentis-Polygonion bistortaeBr.-Bl. & Tüxen ex Marschall 1947
Praterie a Deschampsia cespitosa e Galium palustre
Erbai
Comunità a Festuca rubra e Bistorta officinalis
Praterie a Deschampsia cespitosa e Galium palustre della Foresta del Cansiglio
Combinazione specifica caratteristica: Deschampsia cespitosa, Agrostis capillaris, Stellaria graminea, Cruciata glabra, Galium palustre, Achillea stricta.
Sinfisionomia: praterie ad alte erbe dominate da Deschampsia cespitosa, Phleum pratense, Homalotricon pubescens e, limitatamente ad alcune sottounità, da Festuca rubra, Festuca pratensis e Poa trivialis. Al di sotto di queste si sviluppa uno strato dominato da graminoidi minori e da una elevata quantità di specie di piccola taglia.
Sinecologia: praterie umide che si sviluppano su suoli umidi e ricchi in argille, probabilmente in collegamento con le contigue faggete montane (Dentario pentaphylli-Fagetum sylvaticae), in zone pianeggianti, su lievi pendii e all’interno delle doline.
Sincorologia: diffuse in tutto il territorio studiato (Pian Cansiglio, Pian di Valmenera, Campedei, Cornesega, Pian delle Code).
Variabilità: si sono potute individuare le seguenti subassociazioni:
1. subassociazione 1 a Urtica dioica e Myosoton aquaticum. Si colloca su rive più ripide di lame, orli superiori di doline e porzioni di prato alla base di pendii.
Specie fungine rilevate solo in questa subassociazione: vedi tab. n° 1
2. subassociazione 2 tipica senza proprie specie differenziali. Specie fungine rilevate solo in questa subassociazione: vedi tab. n° 1
3. subassociazione 3 a Ranunculus acris e Cerastium holosteoides. Rappresenta le superfici adibite a pascolo. Specie fungine rilevate solo in questa subassociazione: vedi tab. n° 1
4. subassociazione 4 ricca di varie specie di Juncus. Corrisponde al ciglio pianeggiante di lame con accumulo di suoli fangoso-limosi. Specie fungine rilevate solo in questa subassociazione: vedi tab. n° 1
5. subassociazione 5 a Potentilla erecta e Succisa pratensis. È presente sul bordo superiore delle doline, dove ci sono una elevata umidità e acidità. Specie fungine rilevate solo in questa subassociazione: vedi tab. n° 1.
Praterie da Trasemina della Foresta del Cansiglio
Tra i prati-pascoli del Cansiglio ce ne sono alcuni (all’interno delle Aziende “Vallorch”, “Le Code” e “Lissandri”) che alcuni decenni fa sono stati oggetto di trasemina con lo scopo di aumentare la quantità e la qualità del foraggio con piante più appetibili al bestiame, utilizzando poche specie di graminacee. Attualmente subiscono circa 2 tagli all’anno, 2 concimazioni con letame (in primavera e in autunno) e, a periodi, sono utilizzati come pascoli. Questi “erbai” derivano dalle praterie a Deschampsia cespitosa, ma il numero di specie in essi presenti è meno di un terzo di quelle che ci sono nelle praterie originarie, perciò si può affermare che l’aumento della biomassa ha determinato una diminuzione della biodiversità.
Combinazione specifica caratteristica: Poa pratensis, Poa trivialis, Trifolium repens, Trifolium pratense, Alopecurus pratensis, Dactylis glomerata, Phleum pratense, Deschampsia cespitosa, Rumex acetosa, Ranunculus repens e Taraxacum officinale.
Specie fungine rilevate solo negli erbai: vedi tab. n° 1.
Praterie a Festuca rubra e Bistorta officinalis
Combinazione specifica caratteristica: Festuca rubra, Agrostis capillaris, Stellaria graminea, Bistorta officinalis, Arnica montana unitamente ad alte erbe come Deschampsia cespitosa.
Sinfisionomia: praterie caratterizzate dalla codominanza di Festuca rubra, Agrostis capillaris, Stellaria graminea e dalle appariscenti fioriture di Arnica montana, Bistorta officinalis, Cirsium heterophyllum e Hypericum maculatum. Nello strato inferiore abbondano Trifolium repens, Campanula scheuchzeri, Ranunculus acris, Potentilla erecta e Nardus stricta.
Sinecologia: praterie su suoli da pianeggianti a moderatamente inclinati, su roccia madre calcareo-marnosa che dà origine a suoli da argillosi a pietrosi, mediamente poveri in nutrienti e con locale acidificazione.
Sincorologia: presenti in Campo di Mezzo e in Campo di Sopra.
Specie fungine rilevate solo in questa comunità: vedi tab. n° 1.
Altre specie fungine raccolte solo nelle praterie a Deschampsia cespitosa, senza una particolare predilezione ecologica: vedi tab. n° 1.
Altre specie fungine raccolte in tutti e tre i tipi di praterie, senza alcuna predilezione ecologica: vedi tab. n° 1.
Considerazioni micologiche
Le ricerche micologiche hanno avuto come risultato l’osservazione, lo studio e la catalogazione di 492 raccolte e hanno portato all’individuazione di 163 differenti specie fungine. In conformità con la maggior parte delle ricerche finalizzate alla conoscenza della flora micologica di un dato territorio, i risultati si sono incentrati sulla presenza delle diverse specie e sul loro significato ecologico, trascurando ulteriori valutazioni di ordine quantitativo.
Appartenenza ai gruppi sistematici: 150 Basidiomycota (92% del totale, compresa 1 “ruggine”), 10 Ascomycota (6%), 2 Zygomycota, 1 Myxomycota.
Appartenenza ai gruppi trofici: 88 saprotrofi umicoli (54%), 17 saprotrofi umicoli-fimicoli (10%), 17 saprotrofi lignicoli (10%), 13 saprotrofi fimicoli (8%), 9 saprotrofi muscicoli (6%), 8 ectomicorrizici (5%), 7 saprotrofi di lettiera (5%), 2 parassiti (1%), 1 saproparassiti (0,5%), 1 batteriofago (0,5%).
Considerato che le ricerche si sono concentrate su aree prative, con scarsa e marginale presenza di piante d’alto fusto (il peccio, soprattutto), non ci sorprende l’enorme sproporzione tra la componente saprotrofa complessiva (145 specie su 163, pari al 89% del totale) rispetto ai rimanenti gruppi trofici (che assommano complessivamente ad un modesto 11%).
È però necessario evidenziare che in 35 aree di saggio su 46, pari al 76% del totale, rappresentative di tutte le subassociazioni, una non trascurabile quota della componente saprotrofa ricade nei gruppi trofici dei fimicoli/umicoli o dei fimicoli (30 su 163, pari al 19% del totale delle specie censite). Questa circostanza ci induce a considerare con cautela la potenziale correlazione tra queste specie fungine e ambiente perché, se da un lato una lasca relazione tra “fungo” e pianta è possibile per la categoria dei fimicoli/umicoli, dall’altra l’erraticità degli animali pascolanti (con riferimento alla maggiore mobilità dei cervi) rende impossibile stabilire una netta relazione territoriale tra le deiezioni animali, le specie fimicole su di esse presenti, le aree di saggio interessate al fenomeno e conseguentemente le diverse associazioni vegetazionali.
In accordo con buona parte della letteratura (Knudsen & Vesterholt, 2008), ben 20 specie sono state rinvenute direttamente associate a cespi basali di Deschampsia cespitosa: Agrocybe elatella, A. pediades, A. praecox, Conocybe juniana, C. macrospora, C. semiglobata, C. pubescens, Entoloma sericeum, Hemimycena cf. delectabilis, Hygrocybe conica, Lepista sordida, L. subconnexa, Lycoperdon pratense, Marasmius oreades, Mycena aetites, Panaeolina foenisecii, Panaeolus papilionaceus, Protostropharia semiglobata, Psilocybe semilanceata, P. subviscida.
Numerose specie saprotrofe sono state rinvenute su steli erbacei deteriorati o marcescenti presenti nelle zone di confine in diverse aree di saggio (Senecio sp., Rubus sp.); in particolare su Cirsium eriophorum sono stati rinvenuti: Calyptella capula, Hymenoscyphus herbarum, H. repandus, Lachnum virgineum, Leptosphaeria doliolum, Nodulosphaeria cirsii, Pirottaea brevipila, P. nigrostriata, Typhula micans.
Delle 163 specie di macromiceti rilevate:
– 99 si sono dimostrate “esclusive” di una stessa associazione o subassociazione,
– 64 si sono dimostrate comuni ad associazioni o subassociazioni diverse.
La subass. 3 si è dimostrata essere la più ricca di specie fungine [89, di cui ben 40 (45%) esclusive di questa subass.] seguita dalla subass. 1 [61, di cui 25 (39%) esclusive di questa subass.]. Questi risultati verranno più esaurientemente commentati nel capitolo dedicato alla “Diversità micologica e floristica nelle praterie”.
Tra le prime 99, le seguenti 8 specie sono risultate presenti in almeno due diverse aree di saggio che si riferiscono ad un’unica subassociazione; possiamo dunque ritenere queste specie come indicatrici ambientali.
Agaricus campestris Scop. – La crescita di questa specie sembra limitata al mese di ottobre, quando è stata rinvenuta in ben tre differenti aree di saggio appartenenti alla subass. 3 . Si tratta di una specie saprotrofa umicola, molto comune e tipica dei luoghi aperti, specialmente dei prati a matrice calcarea (Cappelli, 1984).
Conocybe apala (Fr.) Arnolds [= Conocybe albipes Hauskn.] – Specie autunnale dei pascoli e dei prati calcifili (nel mese di ottobre in due aree di saggio ricadenti nella subass. 3) della sezione Candidae, caratterizzata dai colori chiari, le lamelle debolmente deliquescenti, le spore grandi (Bon, 1992; Hausknecht, 2009).
Conocybe brunneidisca (Murrill) Hauskn. – Si tratta di una specie caratteristica dei prati e dei pascoli, in genere su suoli fertilizzati e ricchi di nutrienti (Bon, Hausknecht, 2009), come anche da noi verificato in due siti della subass. 3. Un elemento su cui si basa il suo riconoscimento è dato dal profilo debolmente angoloso delle spore.
Galerina graminea (Velen.) Kühner [= Galerina laevis Singer] – Piccola specie calcifila, molto comune nei mesi freschi dalle dune costiere, ai bordi delle strade, ai prati-pascoli, dove vive tra piccoli muschi ed erba (due aree di saggio della subass. 3); (De Haan & Walleyn, 2002).
Hygrocybe helobia (Arnolds) Bon – Come molte altre Hygrocybe, si tratta di una specie saprotrofa del suolo, tipica dei pascoli seminaturali (Bon, 1990; Campo, 2015). È stata da noi rinvenuta nel mese di ottobre in due siti afferenti la subass. 3.
Gliophorus psittacinus (Schaeff.) Herink [= Hygrocybe psittacina (Schaeff.) P. Kumm.] – Altra igrocybe autunnale dei pascoli seminaturali (in tre diverse aree di saggio della subass. 3), molto frequente, facilmente riconoscibile per l’aspetto glutinoso e per i colori sgargianti (inde nomen); (Bon, 1990; Campo, 2015).
Lepista subconnexa (Murrill) Harmaja – La ricchissima subass. 3 (in tre separati siti) ci proporre questa specie palesemente cespitosa, caratterizzata da una colorazione biancastro-beige, dall’igrofaneità della cuticola pileica, dalle lamelle debolmente decorrenti e da un odore fragrante-sgradevole (Christensen & Gulden in Knudsen & Vesterholt, 2008); le nostre raccolte si manifestavano strettamente contigue a cespi di Deschampsia cespitosa.
Ga lerina vittiformis f. tetraspora Arnolds – Questa specie è l’unica rappresentate della subass. 5 rinvenuta, nella sua forma tetrasporica, in due diverse stazioni di crescita; si tratta di un saprotrofo muscicolo delle praterie umide, spesso associato a Rhytidiadelphus sp. (De Haan & Walleyn, 2006).
Tra le 64 specie che possiamo definire “generaliste”, segnaliamo solo quelle presenti in più di tre associazioni o subassociazioni, indipendentemente dal numero di volte in cui sono state campionate e dal numero delle aree di saggio in cui sono state rinvenute.
Psilocybe semilanceata (Fr.) P. Kumm. – Questo noto fungo allucinogeno (contiene i due alcaloidi Psilocibina e Psilocina) è apparso 11 volte in 6 diverse associazioni vegetazionali su 7 (apparentemente assente nella sola subassociazione 4 delle praterie a Deschampsia). Si tratta si un saprotrofo umicolo tipico dei pascoli, delle praterie con suolo concimato (Vestrholt in Knudsen & Vesterholt, 2008); in letteratura P. semilanceata viene spesso associata alla graminacea Deschampsia cespitosa, come anche noi abbiamo potuto verificare, talvolta anche su terreno mescolato a vecchie deiezioni bovine.
Lycoperdon pratense Pers. [= Vascellum pratense (Pers.) Kreisel] – “Gasteromicete” molto comune nei prati-pascoli e nelle zone erbose ai margini delle strade, dove vive come saprotrofo umicolo; è risultato la specie, in termini assoluti, più frequente durante l’indagine con 25 ritrovamenti effettuati in 5 diverse associazioni vegetazionali (Pilat, 1958; Calonge, 1975; Julich, 1989).
Lycoperdon excipuliforme (Scop.) Pers. [= Calvatia excipuliformis (Scop.) Perdeck] – Altra specie saprotrofo – umicola frequente nei prati e nelle radure, presente in 5 diverse associazioni; tra i “gasteromiceti” è sicuramente una delle specie più polimorfe (Pilat, 1958; Calonge, 1975; Julich, 1989).
Mycetinis alliaceus (Jacq.) Earle ex A.W. Wilson & Desjardin [= Marasmius alliaceus (Jacq.) Fr. = Gymnopus alliaceus Murrill] – Questa specie dal caratteristico odore agliaceo è un saprotrofo di lettiera tipico dei boschi di latifoglie, in particolare di faggio (Bon, 1999). Desta dunque molta curiosità il suo ritrovamento in quattro diversi prati distribuiti in altrettante categorie ecologiche (4 diverse associazioni).
Lepista sordida (Schumach.) Singer – Saprotrofo umicolo dei giardini e degli ambienti aperti su suoli in genere ricchi di azoto; di questa specie si sono eseguite 9 raccolte in 4 diverse associazioni vegetazionali, spesso associata a cespi basali di Deschampsia cespiotosa.
Macrolepiota procera (Scop.) Singer – Questo celeberrimo saprotrofo umicolo, tipico dei pascoli e delle radure dei boschi, è presente nei nostri rilievi con 10 raccolte distribuite in 4 diverse subassociazioni su 5 riferite alle praterie a Deschampsia.
Mycena aetites (Fr.) Quél. – Classica specie dei prati-pascoli (Robich, 2003) associata ai residui vegetali delle graminacee o direttamente su cespi basali di Deschampsia cespitosa, come da nostri numerosi ritrovamenti (presente con 13 raccolte in 4 diverse associazioni).
Bolbitius titubans (Bull.) Fr. [= Bolbitius vitellinus (Pers.) Fr.] – Saprotrofo fimicolo/umicolo caratteristico dei prati, dei pascoli, dei terreni fertilizzati, del fieno in decomposizione, delle vecchie deiezioni di erbivori, degli ambienti ruderali ecc., rinvenuto 11 volte in 4 subass. diverse.
Panaeolus papilionaceus (Bull.) Quél. [= Panaeolus sphinctrinus (Fr.) Quél.] – Saprotrofo fimicolo/umicolo molto comune nei pascoli, nei prati e bordi di foreste, associato a letame di tutti i tipi o anche direttamente alla base di Deschampsia cespitosa (Gerhardt in Knudsen & Vesterholt, 2008) come in alcuni dei nostri 18 ritrovamenti distribuiti su 4 diverse subass. delle praterie a Deschampsia.
Protostropharia semiglobata (Batsch) Redhead, Moncalvo & Vilgalys [= Stropharia semiglobata (Batsch) Quél.] – Altro saprotrofo fimicolo tra i più comuni (16 raccolte su 4 diverse ass.); anche in questo caso, come per le specie precedenti, spesso in stretta vicinanza di Deschampsia cespitosa su terreni contenenti deiezioni di erbivori di varia epoca (Ryman in Knudsen & Vesterholt, 2008).
Deconica inquilina (Fr.) Romagn. [= Psilocybe inquilina (Fr.) Bres.] – Questa specie, recentemente separata dal genere Psilocybe, si è dimostrata molto comune sui terreni indagati, con ben 9 presenze in 4 diverse subassociazioni su 5; si tratta di un saprotrofo umicolo (Vesterholt in Knudsen & Vesterholt, 2008) tipico dei residui vegetali (fogliame e frustuli legnosi marcescenti.)
Quelle che seguono sono 5 specie che possiamo definire frequenti, trovate in numero di volte ≥ 10.
Agrocybe pediades (Fr.) Fayod [= Agrocybe semiorbicularis (Bull.) Fayod] – Saprotrofo umicolo dotato di ampia ecologia (Ryman in Knudsen & Vesterholt, 2008), diffuso dai retroduna sabbiosi all’erba dei prati, dove noi l’abbiamo rinvenuto 10 volte nella sua varietà tipica, spesso direttamente ancorato alla graminacea Deschampsia cespitosa.
Cuphophyllus virgineus (Wulfen) Kovalenko – Specie saprotrofa umicola dei prati seminaturali e dei prati-pascoli (Bon, 1990; Campo, 2015); nella nostra indagine è stato rinvenuto 12 volte nella varietà tipica e 2 nella var. ochraceopallidus (P.D. Orton) E. Campo (quest’ultimo si differenzia per le colorazioni uniformemente caffelatte o nocciola-carnicine del cappello e per i toni più pallidi su lamelle e gambo).
Entoloma sericeum Quél. – Saprotrofo umicolo in piccoli gruppi nelle praterie a varie altitudini, nelle zone di ricerca anche tra cespi basali di Deschampsia cespitosa; rinvenuto 9 volte nella forma tipica e 1 volta nella f. nolaniforme (Kühner & Romagn.) Noordel. (Noordeloos, 1992, 2004).
Panaeolina foenisecii (Pers.) Maire – Specie saprotrofa fimicolo/umicola in prati concimati, bordi erbosi nei boschi, a varie latitudini, anche tra l’erba delle dune; tra le nostre 20 raccolte, alcune erano saldamente associate a cespi basali di Deschampsia cespitosa.
Panaeolus fimicola (Pers.) Gillet – Tipico saprotrofo fimicolo/umicolo su escrementi misti a humus, individuato in 10 raccolte microscopicamente separate da altre specie congeneri sulla base di piccoli elementi microscopici (Gerhardt in Knudsen & Vesterholt, 2008).
Aspetti micologici diversi
“Gasteromiceti” epigei – Si tratta di un raggruppamento basato su caratteri morfologici facilmente riscontrabili, quindi mantenuto per motivi di praticità nonostante i moderni studi filogenetici abbiano rilevato il carattere artificioso, polifiletico del gruppo (Boccardo et Al., 2008). Sono molto ben rappresentati con presenze in tutte le associazioni individuate nell’area considerata dalla ricerca (a parte la subass. 4 a Deschampsia cespitosa, costituita da un numero inferiore di siti) con i tre generi Bovista (14 racc. per 2 sp.), Bovistella (2 racc. per 1 sp.) e Lycoperdon (39 racc. per 6 specie), che la biologia molecolare attualmente tende ad assegnare alla famiglia Agaricaceae. Si tratta di organismi saprotrofi per lo più associati a detriti vegetali contenuti nel terreno (Pilat, 1958; Calonge, 1975; Julich, 1989).
Cuphophyllus canescens (A.H. Sm. & Hesler) Bon – Si tratta di una specie americana estremamente rara in Europa; la presente, salvo errore, risulta essere la seconda segnalazione italiana dopo quella del 2015 proveniente da un pascolo alpino della Val di Non (comunicazione di E. Campo). Si distingue dalle specie congeneri per il cappello asciutto e tomentoso, per le tinte grigio-cenere diffuse in tutto il basidioma e per le piccole spore subglobose (Boertmann in Knudsen & Vesterholt, 2008).
Genere Conocybe Fayod – È di gran lunga il genere maggiormente rappresentato nell’area indagata, con 18 specie individuate tra 45 raccolte distribuite in 21 prati afferenti 5 associazioni sulle 7 considerate da questo studio. La circostanza è facilmente spiegabile con l’appartenenza del genere al gruppo funzionale dei funghi saprotrofi, crescenti sui terreni grassi, concimati, su cumuli di compost, sulle lettiere erbacee, nei prati concimati e in generale nei pascoli, in minima parte anche direttamente su letame: tutti ambienti largamente sviluppati nella Foresta del Cansiglio e, a maggior ragione, nelle aree soggette a indagine (Hausknecht & Vesterholt in Knudsen & Vesterholt, 2008; Hausknecht, 2009).
Genere Panaeolus (Fr.) Quél. – Comprendendo anche Panaeolina foenisecii, di questo gruppo sono state effettuate 58 raccolte appartenenti a 7 specie diverse presenti in tutte le associazioni. Tutto il gruppo è rappresentato da specie strettamente saprotrofe crescenti nei prati, nei pascoli, su suoli concimati, misti a deiezioni animali o su detriti vegetali marcescenti (Gerhardt in Knudsen & Vesterholt, 2008).
Genere Pilobolus Tode (Zygomycota, Mucorales, Pilobolaceae) – Le specie di questo genere di funghi “inferiori” si sviluppano sulle deiezioni di erbivori (mucche e cervi) in particolari condizioni di temperatura e umidità; si tratta di funghi decompositori che, per la forma e il loro modo di disperdere le spore nell’ambiente, sono chiamati fungo “dung cannon”, fungo “fucile da caccia” o anche fungo “bombardiere”. Parte del ciclo biologico di questo organismo è ospitata dall’apparato digerente dell’animale, il quale introduce le spore assieme al foraggio. Essendo molto resistenti, le spore passano indenni attraverso il sistema digestivo dell’animale e vengono espulse con le deiezioni, dove germinano dando origine al micelio. I corpi fruttiferi sono costituiti da un piccolo tubo (columella) che evolve in un’ampolla trasparente (sporangioforo) portante alla sommità una lente nerastra (sporangio) contenente le spore. Quando l’aumento della pressione del liquido contenuto nell’ampolla non sarà più sopportabile, liquido e sporangio vengono proiettati ad una distanza compresa tra 2 e 3 metri. In soli 25 millisecondi lo sporangio raggiunge una velocità prossima a 100 km/h che costituisce la maggiore accelerazione in qualsiasi essere vivente noto, appiccicandosi ai substrati erbacei dove sarà pronto per un nuovo ciclo vitale.
responsabile di una grave infezione all’apparato respiratorio conosciuta come “bronchite parassitaria dei bovini”. Entrando nel fungo a partire dal comune substrato costituito dalle deiezioni animali, le larve del nematode si concentrano nell’ampolla dalla quale vengono espulse assieme allo sporangio fungino, rendendosi disponibili sulla vegetazione circostante. Ritornano pertanto nel tubo digerente dell’erbivoro, penetrano nell’organismo attraverso la parete intestinale e, alla fine di un complesso ciclo vitale, si trasferiscono nel sistema linfatico raggiungendo i polmoni, sede finale degli adulti. Il fungo viene dunque utilizzato dal nematode come veicolo per la diffusione dell’infezione.
Durante le nostre ricerche abbiamo scoperto la coesistenza di due specie di Pilobolus che, stando alla letteratura vigente, si separerebbero sostanzialmente in funzione di una notevole diversità nelle dimensioni sporali e nel relativo quoziente: Pilobolus crystallinus (F.H. Wigg.) Tode (spore 7-10 x 4,5-6 μm, ellissoidi, Q = 1.5-1.6) e Pilobolus kleinii Tiegh. (con spore 10-20 x 5,5-9 μm, lungamente ellittiche o subcilindriche, Q = 1.8-2.1).
“Star jelly”
In data 8.10.2015 in località Valmenera (in un’area di saggio ricadente nella subass.3) siamo stati testimoni del ritrovamento di uno strano oggetto dalle caratteristiche molto particolari: si trattava di alcuni ammassi irregolarmente globosi, di 2-5 cm di diametro, di una sostanza umida biancastra, traslucida, opaca, molle, gelatinosa, inodore, apparentemente appoggiata sul terreno, tra l’erba. All’esame microscopico si evidenziavano laschi filamenti non chiaramente riconducibili ad ife fungine; né erano osservabili basidi e spore. In seguito a disidratazione, il campione si è ridotto in condizioni tali da non permettere ulteriori studi. Una ricerca nel web (per tutti: http://new-cryptozoology.wikia. com/wiki/Star_Jelly?oldid=7921) ci ha permesso di confrontare la nostra raccolta con numerosi altri ritrovamenti documentati per la Scozia, l’Inghilterra, il Massachusetts e il Canada, tutti con le medesime caratteristiche osservate in Cansiglio; non mancano le segnalazioni per l’Italia Settentrionale (Maniago, Passo San Pellegrino, comunicazione personale di F. Bersan). Un dato costante a tutti i ritrovamenti degli ammassi gelatinosi è la loro apparizione in località a clima temperato fresco, dove si rinvengono adagiati nell’erba dei prati, senza apparente legame al substrato.
Nei paesi anglosassoni questa sostanza viene comunemente chiamata “star jelly” (gelatina stellare), nome derivante dal folclore inglese che testimonia l’antica conoscenza del fenomeno. Nome che anche noi, per pura comodità, attribuiamo al nostro ritrovamento, dopo però averlo prudentemente scartato dall’elenco micofloristico. Al netto delle interpretazioni di fantasia, molti hanno tentato di dare spiegazioni logiche alle “star jelly”. Una delle più accreditate ritiene che le masse gelatinose non siano altro che il fungo Myxarium nucleatum Wallr.; tuttavia i campioni di “star jelly” da noi rinvenuti, a dispetto dell’apparente somiglianza con questa specie fungina, non stanno sui rami delle piante e non crescono come parassite su pirenomiceti, hanno una consistenza più liquida e una maggiore trasparenza. Inoltre non hanno al loro interno i caratteristici corpuscoli calcarei, non possiedono spore e neppure i tipici basidi tremelloidi.
Con riguardo alle altre ipotesi maggiormente accreditate, c’è chi sostiene che possa trattarsi di colonie dei cianobatteri Nostoc, un tipo di alghe blu-verdi di acqua dolce che forma colonie costituite da filamenti di cellule subglobose in una guaina gelatinosa; ma anche quest’ipotesi è da scartare, considerata l’assenza delle peculiari catenelle di cellule rotondeggianti. Altri studiosi sono invece orientati a ritenere le “star jelly” ammassi di glicoproteine, capaci di aumentare il loro volume con l’idratazione, immagazzinate nell’apparato riproduttivo delle femmine di alcuni anfibi: una teoria poco condivisibile, come anche quella che possa trattarsi, caso remoto, di deposizioni massive di uova al di fuori dall’acqua.
I Pilobolus contengono una sostanza carotenoide fotosensibile, posta alla base dell’ampolla, che li “orienta” sempre nella direzione del sole, inducendoli a lanciare lo sporangio in zone chiare e aperte, disponibili al bestiame (Cacialli et al. 1995).
Sebbene i Pilobolus siano di fatto innocui per gli animali, essi svolgono un ruolo importante nella trasmissione del nematode Dictyocaulus viviparus, parassita
Infine, è necessario rimarcare che sono state eseguite numerose analisi di laboratorio, finalizzate ad individuare strutture cellulari all’interno della sostanza, senza però ottenere nessun risultato; altrettanto infruttuosi si sono dimostrati i test sul DNA. Le “star jelly”, nonostante i numerosi approcci scientifici, si stanno rivelando, almeno per ora, un vero rompicapo.
Tab. 1. Tabella riassuntiva delle
associazioni e subassociazioni prative
della Foresta del Cansiglio con le
specie fungine raccolte in ognuna
di esse. Sono stati inseriti i gruppi
sistematici e i gruppi trofici dopo
gli autori delle specie. Legenda:
A= Ascomycota, B= Basidiomycota,
Z= Zygomycota, M= Myxomycota
SU= saprotrofi umicoli
SM= saprotrofi muscicoli
SF= saprotrofi fimicoli
SLi= saprotrofi lignicoli
SLe= saprotrofi di lettiera
SPLi= saproparassiti lignicoli
SFU= saprotrofi fimicoli/umicoli
ECT= ectomicorrizici
PAR= parassiti
BAT= batteriofagi.
Diversità micologica e floristica nelle praterie
Per conoscere la diversità specifica esistente nei 3 tipi di praterie oggetto di studio, è stato espresso il grado di biodiversità in modo quantitativo attraverso il calcolo dell’indice di ricchezza assoluto (IR, corrispondente al numero di specie) sia per la flora vascolare che per quella micologica. Si è voluto indagare anche un eventuale rapporto tra il grado di biodiversità e gli indici ecologici di Landolt relativi all’ umidità e ai nutrienti (Borsato, 2016).
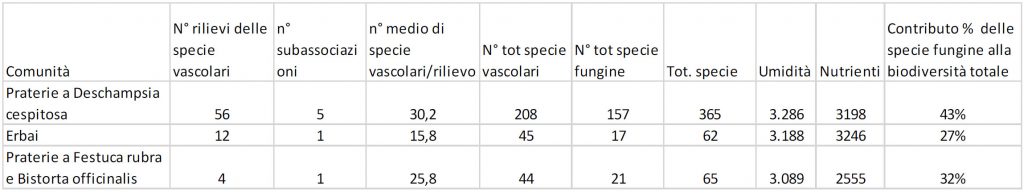
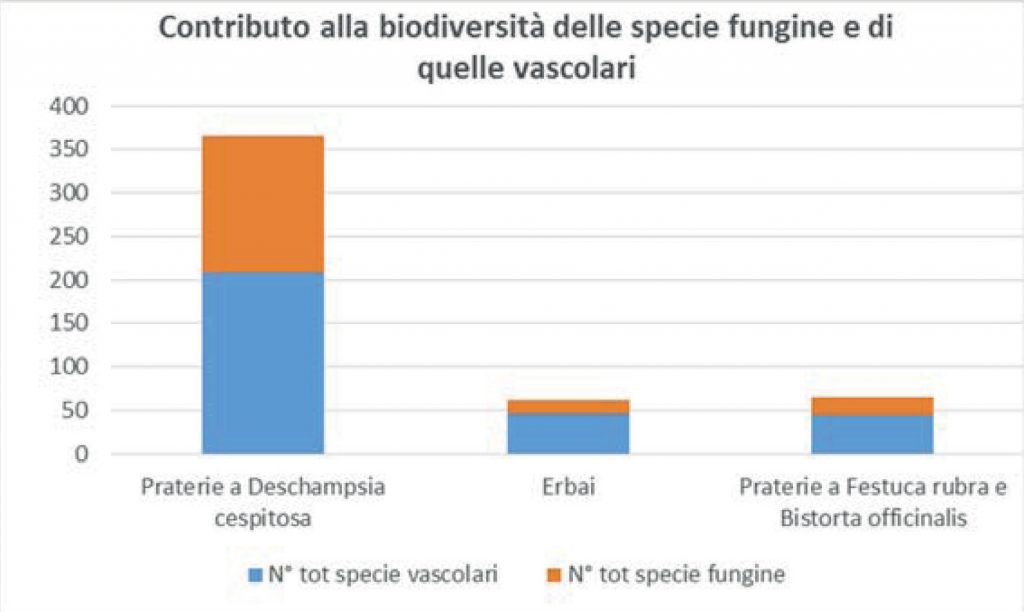
Come appare evidente nella tab. 2 la ricchezza delle specie fungine segue l’andamento di quella delle specie vascolari: entrambe sono numerose nelle praterie a Deschampsia cespitosa, poco numerose negli erbai e nelle praterie a Festuca rubra.
Le comunità più ricche di specie sono le praterie a Deschampsia cespitosa (con ben 365 specie in totale); le più povere sono gli erbai (con 62 specie in totale) e le comunità a Festuca rubra (con 65 specie in totale). Ciò si potrebbe spiegare con il fatto che i Deschampsieti del Cansiglio hanno al loro interno ben 5 subassociazioni caratterizzate da condizioni ecologiche diverse, come emerso nella descrizione al paragrafo “Variabilità”. Osservando la tabella, parrebbe esserci un certo rapporto tra l’indice di umidità, la flora vascolare e quella fungina: nelle praterie del Cansiglio all’aumentare della umidità aumenta anche la biodiversità. Negli erbai il numero di specie dovrebbe essere maggiore rispetto alle comunità a Festuca rubra in base all’indice di umidità, ma probabilmente ciò non è reso possibile dal fatto che le praterie da trasemina costituiscono un ambiente meno adatto ai funghi rispetto agli altri tipi di prato.
Per quanto riguarda l’indice dei nutrienti si nota come il suo elevato valore negli erbai non favorisce la biodiversità, ma solo la biomassa delle specie vascolari. È dunque evidente che negli erbai l’aumento della biomassa ha portato alla diminuzione della biodiversità delle due componenti esaminate, quella micologica e quella vascolare.
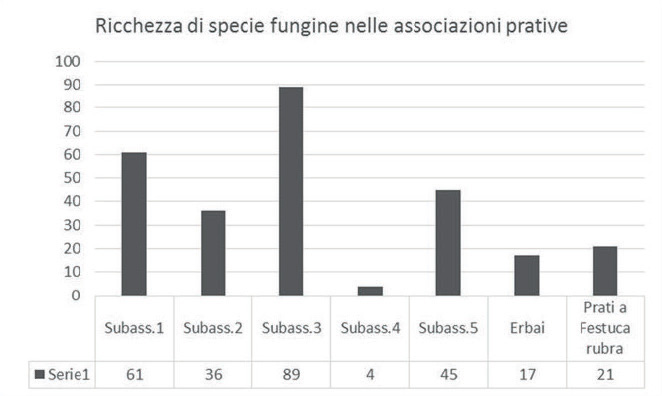
Se inoltre viene valutata la ricchezza di specie fungine nelle varie subassociazioni (Fig. 3), si può vedere come la più ricca sia quella corrispondente alle superfici adibite a pascolo (n° 3), mentre quella più povera sia quella corrispondente al ciglio pianeggiante delle lame, con accumulo di suoli fangoso-limosi (n° 4) in cui l’acqua funge da fattore limitante, anche perché il suo livello è soggetto a continue variazioni nel corso delle stagioni e degli anni.
Conclusioni
Nelle praterie del Cansiglio sono state individuate 163 specie di funghi, distribuite in modo molto diversificato nelle varie comunità prative presenti dentro la Foresta. Alcune specie fungine inoltre sono state rilevate esclusivamente in alcune comunità e non in altre, perciò potremmo pensare che, assieme a una flora vascolare caratteristica, ci sia anche una micoflora tipica. Non essendoci studi simili riguardanti le praterie a Deschampsia cespitosa e a Festuca rubra, non abbiamo dati per il confronto.
Nelle praterie a Deschampsia cespitosa il numero di specie fungine e vascolari è molto elevato rispetto alle praterie a Festuca rubra e agli erbai e ciò potrebbe essere dovuto a una maggiore umidità, favorevole all’instaurarsi di numerose specie. Se però entriamo nel dettaglio, si può notare come nei bordi fangoso-limosi delle lame, le comunità a Deschampsia cespitosa sono più povere in quanto l’acqua funge da fattore limitante. La drastica diminuzione della flora micologica (associata a quella della flora vascolare) negli erbai, dimostra ancora una volta che “all’aumentare della biomassa delle piante vascolari, la biodiversità diminuisce”. A questa conclusione siamo giunti pur non essendo supportati da dati di letteratura, in quanto questo approccio metodologico non è mai stato considerato in passato a riguardo dei funghi dei prati. Si potrebbe ipotizzare che il calo del numero di specie negli erbai sia dovuto alla loro omogeneità, mentre nelle praterie a Deschampsia l’elevata biodiversità pare dovuta al fatto che in esse si diversificano ben 5 subassociazioni, e questo favorisce la possibilità di reperire un maggior numero di specie.
È altrettanto interessante notare come nelle praterie a Deschampsia cespitosa le specie fungine contribuiscono per ben il 43% (quasi la metà!) alla biodiversità valutata in questo studio, negli erbai per il 27% e nelle comunità a Festuca rubra per il 32% (Fig. 2).
Ringraziamenti
Per gli utili suggerimenti si ringraziano Franco Bersan, Gabriele Cacialli, Mariano Curti, Rossano Giolo, Livio Lorenzon, Cristiano Losi e Giovanni Robich per la parte micologica; in particolare Emanuele Campo per la revisione critica del manoscritto. Per la botanica si ringraziano il Prof. Livio Poldini e la Dott.ssa Paola Ganis (UNITS) e Giovanni Roffarè (Giardino Botanico Alpino del Cansiglio).
Bibliografia
Aa.Vv. (1964-1993) – Flora europaea . Cambridge University Press.
Aeschimann D., Lauber K., Moser D.M., Theurillat J.P. (2004) – Flora alpina. Zanichelli.
Anderberg M.R. (1973) – Cluster analysis for applications, Wiley, New York, NY, US.
Bacic T., Dolenc Koce J. & N. Jogan (2007) – Luzula sect. Luzula (Juncaceae) in the South-Estern Alps: morphology, determination and geographic distribution. Botanica Helvetica 117(2007): 75-88.
Bernini A., Marconi G., Polani F. (2002) – Campanule d’Italia e dei territori limitrofi. Verba & Scripta s.a.s. – Pavia.
Biondi E., Blasi C., Allegrezza M., Anzellotti I., Azzella M.M., Carli E., Casavecchia S., Copiz R., Del Vico E., Facioni L., Galdenzi D., Gasparri R., Lasen C., Pesaresi S., Poldini L., Sburlino G., Taffetani F., Vagge I., Zitti S., Zivkovic L. (2014) – Plant communities of Italy: The Vegetation Prodrome. Plant Biosystems, vol. 148, No. 4, 728-814.
Bizio E., Borsato V. (2016) – Indagine preliminare dei macromiceti associati alle comunità vegetali delle zone umide della Foresta del Cansiglio (Veneto-NE-Italia). Lavori Soc. Ven. Sc. Nat. 41: 87-113
Boccardo F., Traverso M., Vizzini A., Zotti M. (2008) – Funghi d’Italia: 360-375. Zanichelli Editore, Bologna
Bon M. (1990) – Flore Mycologique d’Europe . Les Hygrophores. Documents Mycologiques Mémoire Hors Série n° 1. Hygrophoraceae Lotsy. Amiens.
Bon M. (1999) – Flore Mycologique d’Europe. Les Collybio-marasmïoïdes et ressemblants. Documents Mycologiques Mémoire hors série n° 5. (Ordre Tricholomatales, Sous ordre Collybiineae) Amiens.
Bon M. (1992) – Clé monographique des espèces galero-naucorioides. Doc. Mycol., XXI(84): 1-84.4
Borsato V. (2016) – Il SIC-ZPS Foresta del Cansiglio e la sua biodiversità. Pubblicazione in proprio.
Borsato V. (2017) – La flora vascolare delle zone umide e delle praterie del SIC-ZPS IT 3230077 “Foresta del Cansiglio, Regione Veneto. Lavori Soc. Ven. Sc. Nat. 42 : 43-52
Busato P.A., G.G. Lorenzoni (1971) – Considerazioni sull’inversione di vegetazione nelle depressioni del Cansiglio. Atti del 3° Convegno sulla storia naturale delle Prealpi Venete, bosco del Cansiglio, 3-5 settembre 1971.
Busato P.A. (1964-65) – Osservazioni floristiche nel Cansiglio. Tesi di laurea in Botanica, Università degli Studi di Padova.
Calonge, F.D. & V. Demoulin (1975) – Les Gastéromycètes d’Espagne. Bulletin de la Société Mycologique de France 91(2): 247-292
Campo E. (2015) – Hygrophorus, Hygrocybe e Cuphophyllus del Friuli Venezia Giulia. Grafiche Scarpis, Sacile
Cancian G., Ghetti S., Semenza E. (1985) – Aspetti geologici dell’Altopiano del Cansiglio, Lavori – Società Veneziana di Scienze Naturali -Suppl. Vol. 10, pp.79-90, Venezia,15-3-1985.
Cappelli A. (1984) – Agaricus L.: Fr. ss. Karsten (Psalliota Fr.). Fungi Europaei 1: 346.
Dalla Fior G. (1985) – La nostra flora. Casa Editrice G.B. Monauni, Trento.
De Conti P. (2017) – La flora vascolare dei prati del monte Pizzoc (Veneto- NE-Italia) . Lavori Soc. Ven. Sc. Nat. 42 : 53-60
De Haan A. & Walleyn R. (2002) – Studies in Galerina. Galerina Flandriae (1). Fungi non Delineati 23: 1-66. Edizioni Candusso.
De Haan A. & Walleyn R. (2006) – Studies in Galerina. Galerina Flandriae (2). Fungi non Delineati 33: 1-73. Edizioni Candusso.
De March G. (1994) – Effetti del pascolamento bovino, ovino e caprino su un pascolo migliorato del Cansiglio, tesi di laurea in Scienze Forestali, UNIPD.
Del Favero R. (2004) – “Biodiversità e indicatori nei tipi forestali del Veneto”, Multigraf, Spinea (VE).
Direttiva n° 92/43/CEE(Direttiva habitat).
Eggenberg S. & Mohl A. (2013) – Flora vegetativa, Rossolis.
Eyssartier G. & P. Roux (2011) – Le guide des Campignons, France et Europe. Ed. Belin, Paris Cedex
Festi F. (2000) – Chiave di identificazione per le specie italiane del genere Alchemilla L. (Rosaceae). Ann. Mus. Civ. Rovereto, vol.14 (1998)|105-174|2000.
Fiamoi A. (1985) – Studio vegetazionale delle cotiche erbose di Malga Vallorch (Cansiglio, Belluno), tesi di laurea, UNIPD.
Fischer M.A., Oswald K., Adler W. (2008) – Exkursionsflora fur Osterreich, Liechtenstein, Sudtirol. Biologiezentrum der Oberosterreichischen Landesmuseen, 2008.
Garlato A., Borsato V. (2016) – I suoli del SIC-ZPS IT3230077 “Foresta del Cansiglio” (NE-Italia). Lavori Soc. Ven. Sc. Nat. 41: 115-119.
Gottschlich G. & Pujatti D. (2002) – Il genere Hieracium (Compositae) in provincia di Trento (Nord Italia): chiave di determinazione, descrizione morfologica e distribuzione locale delle specie. Ann. Mus. Civ. Rovereto, Vol. 16 (2000), 273-351, 2002.
Hausknecht A. (2009) – Fungi Europaei. Conocybe & Pholiotina. Edizioni Candusso.
Julich W. (1989) – Guida alla Determinazione dei Funghi. Vol. 2. Aphyllophorales, Heterobasidiomycetes,
KirkP.M. & Ansell A.E. (2003) – Authors of fungal names. A list of authors of scientific names of fungi, with recommended standard forms of their names, including abbreviations index of fungi supplement. England, Wallingford: C.A.B. International.
Knudsen H. & Vesterholt J. (2008) – Funga Nordica. Nordsvamp, Copenhagen- Denmark.
Lauber K. & G. Wagner (2001) – Flora Helvetica. Flora illustrèe de Suisse. 2ème edition Hampt.
Lorenzoni G.G. (1978) – Osservazioni e considerazioni naturalistiche relative al Comprensorio del Cansiglio (Prealpi Venete-Nord Italia), Atti del Conv. Ecol. Prealpi or. – G. Gadio, Pian Cansiglio 6-7-8 maggio 1978.
Marchiori S., RosM. (1978) – Ricerche sui pascoli del M. Pizzoc (Cansiglio): La vegetazione ed alcuni aspetti di degradazione. Atti Conv. Ecol. Prealpi or. -G.Gadio, Pian Cansiglio 6-7-8 maggio 1978.
NoordeloosM.E. (1992) – Fungi Europaei. Entoloma s.l. – Libreria Editrice Giovanna Biella. Saronno
NoordeloosM.E. (2004) – Fungi Europaei. Entoloma s.l. Supplemento. – Edizioni Candusso. Alassio
Oberdorfer E. (1994) – Pflanzen-soziologische Exkursionsflora. 7.Auflage. UTB fur Wissen Schaft, Ulmer.
Pietriboni E. (2001) – Caratteristiche produttive e vegetazionali di pascoli del Cansiglio (BL) utilizzati con diversi carichi e specie animali, tesi di laurea in Scienze Forestali, UNIPD.
Pignatti S. (1982) – Flora d’Italia. Ed. Edagricole.
Pilat A. (1958) – Flora ČSR. – Traduzione del Gruppo Micologico Parmense “G. Passerini”: Gasteromiceti 92-98
Podani J. (2001) – SYN-TAX 2000. Computer programs for data analysis in ecology and systematics. User’s manual. Scientia, Budapest, HU.
Poldini L. con la collaborazione di G.Oriolo e M.Vidali (2002) – Nuovo Atlante corologico delle piante vascolari nel Friuli Venezia Giulia.
Poldini L., Oriolo G., Vidali M. (2001) – La flora vascolare del Friuli Venezia Giulia. Catalogo annotato ed indice sintassonomico. Studia geobotanica. Vol.21: 3-227.
Robich G. (2003) – Mycena d’Europa. A.M.B. Trento.
Rothmaler W. (1995) – Exkursionsflora von Deutschland. GefaBpflanzen:Atlasband. Ed. Gustav Fischer Verlag Jena – Stuttgart.
Veneto Agricoltura (2010) – Piano di gestione della ZPS IT 3230077 “Foresta del Cansiglio, (allegati: A Relazione, B.6 Schede delle azioni, C.7.2 Sistema degli indicatori e protocolli di monitoraggio, D.9 Bibliografia, E.10 Allegati al piano di gestione, 10.2 Rilievi e documentazione fotografica, F.10 Allegati al piano di gestione 10.4 CD banche dati).
Wishart D. (1969) – An algorithm for hierarchical classification. Biometrics, 25:165-170.