Riassunto
Il lavoro espone i risultati di uno studio sulla componente macroalgale eseguito con una meto-dica di rilievo fotografica su 12 affioramenti rocciosi situati nel nord Adriatico e posti a diversa distanza dalla costa (1-28 km) e profondità (10-27 m). Le macroalghe individuate dall’esame delle immagini fotografiche (almeno 10 per affioramento) sono state ripartite in 4 categorie fun-zionali: a) alghe turf (feltri costituiti da sottili filamenti di altezza di 1-2 cm, riconducibili in gran parte alle Rhodophyta); b) alghe erette (talli di vario tipo ramificati, cilindrici, laminari, corticati, lobati, di altezza superiore a 1-2 cm); c) alghe rosse incrostanti interamente calcificate (indicate come “Corallinales”); d) alghe rosse incrostanti parzialmente calcificate (tipo “Peyssonnelia”). Il confronto con una metodica di campionamento distruttiva, eseguita contemporaneamente e sui medesimi siti e che, rispetto alla tecnica fotografica, opera con un livello tassonomico più definito, ha fornito un quadro complessivo paragonabile, confermando il gradiente costa-largo, la ripartizione degli affioramenti nella cluster analysis e il trend degli indicatori copertura e ricopri-mento e degli indici di diversità. Per la rapidità delle operazioni di rilievo, la maggiore sicurezza per gli operatori subacquei scientifici e i minori costi complessivi (in campo e in laboratorio), la metodica fotografica si presta bene per lo svolgimento di monitoraggi pluriennali delle comunità biologiche e per indagini marine ad elevate profondità.
Abstract
Estimation of rocky shore macroalgae in the Northern Adriatic Sea by high-resolution digital photography and comparison with scraping method
In this study, macroalgal assemblages on 12 rocky outcrops in the northern Adriatic Sea located at different distances from the coast (between 1 and 28 km) and depth (between 10 and 27 m) were analyzed by high-resolution digital photography. Macroalgae species, identified by examining digital photographs (at least 10 in each outcrop) were divided into 4 functional groups: a) turf-forming algae (tiny filaments with canopy heights of less than 1-2 cm, especially Rhodophyta) ,b) erect algae (branched, cylindrical, foliaceous, corticated or forming large lobes thalli with canopy heights of more than 1-2 cm), c) encrusting algae (totally calcified) “Corallinales” and d) encrusting algae (par-tially calcified) “Peyssonnelia”. The comparison with direct sampling destructive method performed on the same sites at the same time and characterized by a more defined taxonomic level, has provided the same results, confirming the gradient between coastal and offshore area, the distribution of out-crops in the cluster analysis and the trend of coverage indicators and diversity indices. Because of the speed of the survey, higher safety for scientific divers and lower overall costs (in situ and in labora-tory), the photographic method is well suited for multi-year monitoring of biological communities, in depth marine surveys and in the expeditious ones.
Introduzione
Sui fondali fangoso-sabbiosi del Nord Adriatico sono presenti numerosi affiora-menti rocciosi di diverse dimensioni, denominati localmente “tegnùe”, “trezze” o “grebeni”. La maggior parte è localizzata tra 10 e 30 m di profondità e sino ad una distanza dalla costa di circa 30 km. La loro morfologia è riconducibile a quella dei “bank” con superfici più o meno orizzontali (Pérès & Picard,1964; Laborel,1987) e l’elevazione è per la maggior parte compresa tra 1 e 2 m. Nel quadro della Direttiva Habitat, rientrano nella tipologia di Habitat “1170 Sco-gliere-Reef” dell’Allegato I.
Dando corso all’applicazione delle recenti Direttive Europee (Habitat 92/43/ CEE, Water Framework Directive 2000/60/EC e Marine Strategy 2008/56/EC) e alla necessità di istituire a livello nazionale e regionale aree protette, tre settori marini del nord Adriatico,che includono affioramenti, sono divenuti Siti di Im-portanza Comunitaria (IT3250047 Tegnùe di Chioggia; IT3250048 Tegnùe di Porto Falconera; IT3330009 Trezze San Pietro e Bardelli).
Pur essendo note da tempo (Olivi, 1792), queste rocce affioranti dal fondale sono divenute di ampia conoscenza solo a partire dagli anni ’60 a seguito di lavori di geologia, geofisica e geomorfologia che hanno interessato il Golfo di Venezia (Stefanon, 1967; Newton & Stefanon, 1975; Caressa et al., 2001; Gordini et al., 2004).
Solo negli ultimi 10-20 anni, con l’avvio di campionamenti, sono state acquisite conoscenze sulla comunità bentonica animale (Mizzan, 1992, 1995; Gabriele et al., 1999;Molin et al., 2003, 2010;Casellato&Stefanon, 2008;Ponti&Mescalchin, 2008; Falace et al., 2015) e macroalgale (Curiel & Molin, 2010; Curiel et al., 2001, 2012, 2014).
L’importanza che questi ambienti rivestono oramai, non solo dal punto di vista scientifico, ma anche economico (per la presenza di una pregiata fauna alieutica e come fonte di attrazione del turismo nautico e subacqueo), suggerisce l’im-piego di metodiche di campionamento meno invasive, basate sull’acquisizione di immagini fotografiche. L’analisi a posteriori di queste immagini si è rivelata ugualmente indicativa delle tendenze in atto nelle comunità bentoniche, ren-dendola applicabile in alternativa ai campionamenti diretti distruttivi (Bianchi et al., 2003;Ponti et al., 2011).
Le metodiche non distruttive, riducendo i tempi di permanenza in profondità e limitando le determinazioni di laboratorio, appaiono nel complesso meno one-rose e ben si adattano alla complessità delle immersioni subacquee. Favorisco-no una maggiore sicurezza degli operatori, soprattutto quando si interviene a profondità superiori a 20-30 m, sino alla soglia di una immersione tecnica (oltre 40 m), dove per motivi di sicurezza sono preferibili apparecchiature video/fo-tografiche installate su veicoli a comando remoto (ROV – Remotely Operated Vehicle).
Il presente lavoro, confronta i risultati di uno studio della comunità macroal-gale, eseguito con una metodica fotografica, con quelli di un campionamento distruttivo, eseguito contemporaneamente sui medesimi affioramenti e transetti (Curiel et al., 2014). Il lavoro fa riferimento ad uno studio più esteso promosso dalla Regione del Veneto e dal Ministero delle Infrastrutture e dei Trasporti – Magistrato alle Acque di Venezia tramite il Concessionario Consorzio Venezia Nuova (Studio Op. 499), atto a valorizzare le aree costiere prospicienti le bocche di porto della Laguna di Venezia.
Area di studio
I 12 affioramenti indagati (Figura 1) sono rappresentativi dei gradienti che maggiormente incidono sulla struttura delle comunità bentoniche: distanza dalle bocche lagunari, dai fiumi o da aree soggette alla dispersione di sedimenti, profondità, morfologia (rocce sparse, rocce compatte, lastrure), elevazione ed estensione dell’area di indagine (40 x 30 km). Nella tabella 1 sono sintetizzate le principali caratteristiche degli affioramenti.
Tab. 1. Principali caratteristiche degli affioramenti rocciosi indagati
| Tegnua | Distanza costa (km) | Profondità (m) | Tipologia | Elevazione |
| MA1-003 | 1 | 10 | Rocce sparse | 0,5-1,0 |
| CAORLE | 2,9 | 9-12 | Rocce compatte | 1,0-2,0 |
| LA1-003 | 4 | 13,4 | Rocce sparse | 0,5-2,0 |
| MOTTA SILE | 5,8 | 19 | Rocce compatte | 0,4-2,4 |
| PIAVE | 6,8 | 15-19 | Rocce compatte-lastrure | 3 |
| PICCO | 9,6 | 17-21 | Rocce compatte | 3,0-4,0 |
| PANETTON | 9,8 | 20-21 | Rocce compatte | 2 |
| LASTRE | 10,5 | 19 | Lastrure | 0,5-1,0 |
| PIVETTA | 13,8 | 20 | Rocce compatte-lastrure | 1 |
| TARTARUGA | 15,1 | 19-21 | Rocce compatte | 2 |
| CERNIOTTA | 17,6 | 24 | Rocce compatte | 0,4-2,2 |
| ABATE | 28,8 | 25-27 | Rocce compatte | 2,0-3,0 |
Materiali e metodi
Le attività di campo sono state condotte in aprile 2011. Per ciascun affioramento sulla base di mappe georeferenziate e delle tracce Side Scan Sonar delle batime-trie, è stato identificato un transetto di circa 10-15 m sulla porzione più elevata e su superfici orizzontali, lungo il quale sono stati eseguiti 50 scatti fotografici random di dimensioni 25 x 20 cm. Complessivamente, sui 12 affioramenti sono stati eseguiti 600 scatti fotografici, utilizzando una macchina fotografica da 10 mpixel con due luci laterali e mantenuta, tramite una struttura rigida metallica, sempre parallela e alla stessa distanza dal substrato.
L’attività, svolta in coppia da due operatori, consente al primo di eseguire i ri-lievi fotografici e al secondo di acquisire una serie di parametri aggiuntivi, quali la copertura generale, le macroalghe e gli organismi animali dominanti, i rap-porti di abbondanza delle alghe incrostanti rispetto alla comunità complessiva, utili a definire meglio il quadro globale della colonizzazione macroalgale di un areale più ampio dell’affioramento e che servirà in fase analisi delle immagini a videoterminale.
Nel caso delle macroalghe, per limitare la sottostima dell’abbondanza che que-sta metodologia può portare per alcune specie (es. le alghe coralline, talvolta parzialmente nascoste da altri organismi o da un sottile feltro di sedimento), prima dello scatto, con un debole movimento della mano, si è provveduto ad allontanare parte del sedimento più fine. Riguardo alla metodica di campiona-mento distruttiva eseguita contemporaneamente (raschiamento di 3 quadrati di 50 cm di lato, utilizzando martello, scalpello e sorbona) si rimanda a Curiel et al. (2014).
Le metodiche fotografiche di monitoraggio, pur con un dettaglio inferiore (non rilevano gli organismi di taglia più piccola, pochi mm, presentano difficoltà di lettura ed interpretazione dell’immagine a posteriori, sottostimano l’abbondan-za di talune specie, raggiungono un minore dettaglio tassonomico), sono ampia-mente utilizzate nelle indagini marine, soprattutto quelle ad elevate profondità (oltre 20-30m), per le restrizioni operative imposte dalla immersioni subacquee che limitano la quantità di dati e aumentano lo sforzo di campionamento (Par-ravicini et al., 2010; Gatti et al., 2012). La perdita di informazione tassonomica viene compensata, rispetto ad un campionamento distruttivo, dal maggior nu-mero di repliche (scatti fotografici) e dalla maggiore superficie che può essere indagata (Roberts et al., 1994; Bianchi et al., 2003; Ponti et al., 2011).
Nello specifico, questa metodica ben si adatta agli affioramenti rocciosi del nord Adriatico che, per la riscontrata elevata variabilità spaziale della comunità del coralligeno (Curiel et al., 2012; Ponti et al., 2014; Falace et al., 2015), richiedono un elevato numero di repliche per sito, al fine di ottenere una esau-stiva rappresentazione.
In fase di analisi delle immagini, dopo una prima valutazione, sono state se-lezionate, per ogni affioramento, almeno 10 immagini fotografiche di qualità ottimale (per trasparenza, profondità di campo, nitidezza, piano di ripresa a distanza costante) per il riconoscimento della componente macroalgale. L’ana-lisi a videoterminale delle macroalghe è avvenuta tramite un software di analisi delle immagini del quale si sono sfruttate la capacità di valutare aree, tracciare limiti, riconoscere automaticamente cromatismi simili (Adobe Photoshop). Ciò ha permesso di calcolare la copertura totale delle macroalghe rispetto all’area di analisi (percentuale di spazio vegetato rispetto a quello non vegetato) e del ricoprimento (superficie occupata dagli organismi in proiezione sensu Boudou-resque, 1971), in accordo con le metodiche utilizzate per l’analisi dei campioni mediante raschiamenti (Curiel et al., 2014).
I valori di abbondanza (%) rilevati in ogni immagine sono stati successivamente mediati, permettendo quindi di disporre di un dato medio rappresentativo di un areale di circa 50 m2 per affioramento.
Per il riconoscimento tassonomico delle macroalghe in fase di post-processing, si è fatto riferimento anche alle schede riassuntive compilate in immersione dagli operatori e a collezioni di laboratorio.
Considerando la difficoltà nel riconoscere le specie macroalgali senza una disa-mina al microscopio o al SEM (per le specie calcaree), è stata adottata una meto-dica di valutazione basata sulle categorie funzionali (Diaz-Pulido & Mc Cook, 2008): a) alghe turf (feltri costituiti da sottili filamenti di altezza sino a 1-2 cm, riconducibili in gran parte alle Rhodophyta); b) alghe erette (talli di vario tipo ramificati, cilindrici, laminari, corticati, lobati di altezza superiore a 1-2 cm); c) alghe incrostanti (forme prostrate in prevalenza Rhodophyta calcaree). Per la categoria delle alghe rosse incrostanti, a videoterminale si è potuto distinguere quelle interamente calcificate (es. Lithophyllum, Lithothamnion, Mesophyllum, Neogoniolithon), per semplicità chiamate “Corallinales” (non in senso tassono-mico), da quelle parzialmente calcificate identificate come “Peyssonnelia”.
Questa tipologia di ripartizione per categorie funzionali è ampiamente utilizza-ta in letteratura soprattutto per prime caratterizzazioni, valutazioni dello stato di qualità, analisi del paesaggio marino “seascape approach” e, con gli opportu-ni adattamenti alle realtà dei siti da indagare, è proposta come una rapida tec-nica di valutazione subacquea (Rapid Visual Assessment Technique) che mira più alla caratterizzazione del paesaggio che alle caratteristiche intrinseche della comunità (Bianchi et al., 2007, 2010).
L’analisi dei gradienti e della similarità tra gli affioramenti è stata eseguita me-diante la Cluster Analysis [similarità di Bray-Curtis e trasformazione log (x+1)] (Clarke & Warwick, 1995) e il calcolo degli indici di diversità di Shannon e Pielou (Pielou, 1966; Shannon & Weaner, 1949).
Con procedura Simper del software Primer, sono state individuate le cate-gorie funzionali che caratterizzano i raggruppamenti individuati dalla Cluster Analysis.
Risultati
Nella tabella 2 sono riportati i valori del ricoprimento medio (%) e della coper-tura totale (%) per affioramento delle quattro categorie funzionali, identificate in fase di analisi delle immagini a videoterminale. I dati evidenziano un’elevata variazione dei valori di abbondanza tra gli affioramenti, sia per copertura (da <1 a 85,9% per una media del 40%), sia per ricoprimento (da prossimi allo 0% per tutte le categorie funzionali in LA1-003 ad oltre il 67% in CERNIOTTA per il gruppo funzionale delle “Corallinales”).
In tutti gli affioramenti è scarsa l’abbondanza delle alghe erette (es. le alghe ros-se Halymenia, Rhodymenia, Colpomenia o l’alga verde Ulva) con valori massimi dell’1%. Le alghe turf, che includono soprattutto generi delle alghe rosse (es. Ceramium, Aglaothamnion, Dasya) e di un’alga verde sciafila (Pseudochlorode-smis furcellata), hanno un’ampia variabilità, con valori di ricoprimento <1%,bassi (4-8%) o medio-alti (> 40% nell’affioramento ABATE per l’abbondanza del genere Pseudochlorodesmis). Le alghe parzialmente calcificate “Peyssonne-lia” variano da valori di ricoprimento bassi negli affioramenti sotto costa (0-0,3%; A1-003, MA1-003) e al largo (1,2-1,9%; ABATE, CERNIOTTA), a medi negli affioramenti situati tra la costa e il largo (7,0-22%; es. PIVETTA, PICCO, MOTTA SILE).
Le alghe “Corallinales” interamente calcificate, denotano valori di ricoprimen-to nulli sotto costa (MA1-003, CAORLE, LA1-003) ed elevati al largo (40,3-67,7%; es. TARTARUGA, ABATE, LASTRE, CERNIOTTA).
Come per la copertura e le categorie funzionali, anche gli indici di Pielou e di Shannon mostrano un’ampia gamma di valori, evidenziando una scarsa corre-lazione con la distanza dalla costa. La quasi nulla presenza di macroalghe sui substrati degli affioramenti LA1-003 e MA1-003 impedisce il calcolo dell’indice di Pielou e falsa i risultati di quello di Shannon.
Tab. 2. Valori medi di ricoprimento delle categorie funzionali, della copertura totale algale sul substrato e degli indici di Pielou e Shannon. Le stazioni sono ordinate da sinistra a destra in relazione all’incremento della distanza dalla costa e della profondità.
| Ricoprimento algale (%) | MA1-003 | CAORLE | LA1-003 | MOTTA-SILE | PIAVE | PICCO | PANETTON | LASTRE | PIVETTA | TARTARUGA | CERNIOTTA | ABATE |
| Peyssonnelia | 0,3 | 6,4 | 0 | 14,2 | 7 | 38 | 11,3 | 0,6 | 22 | 9,1 | 1,2 | 1,9 |
| Corallinales | 0 | 0 | 0 | 5,7 | 22 | 7,2 | 22,4 | 41 | 22,1 | 51,3 | 67,7 | 40,3 |
| Turf | 0,2 | 4,1 | 0 | 0,8 | 4,4 | 5,9 | 8 | 0,1 | 1,9 | 1,6 | 5,9 | 43,7 |
| Erette | 0 | 9 | 0 | 0,7 | 0,1 | 0 | 0 | 0,4 | 0 | 0 | 0 | 0 |
| Copertura totale substrato (%) | <1 | 19 | <1 | 21,3 | 33,6 | 51,1 | 41,7 | 42,1 | 45,9 | 62 | 74,8 | 85,9 |
| Indice Pielou | n.r. | 0,88 | n.r. | 0,88 | 0,7 | 0,62 | 0,79 | 0,36 | 0,68 | 0,61 | 0,44 | 0,99 |
| Indice Shannon | 0 | 0,92 | 0 | 0,46 | 0,78 | 0,61 | 0,82 | 0,12 | 0,71 | 0,32 | 0,32 | 0,73 |
La matrice di correlazione di Spearman (Tabella 3) che analizza le interazioni tra parametri ambientali (profondità e distanza dalla costa) con gli indicatori algali, mostra che la distanza dalla costa è statisticamente correlata con la copertura e in modo specifico con quella delle alghe interamente calcificate “corallinales”, mentre per la profondità, si ha correlazione anche con le alghe turf per la forte presenza dell’alga verde sciafila Pseudochlorodesmis furcellata.
Tab. 3. Matrice di correlazione di Spearman tra parametri ambientali e indicatori algali (in grassetto le relazioni statisticamente più significative, p<0,05).
| Correlazione di Spearman | Profondità | Distanza costa | Peyssonnelia | Corallinales | Turf | Erette | Copertura | Pielou | Shannon |
| Profondità | 1 | 0,94 | 0,34 | 0,82 | 0,61 | -0,51 | 0,91 | 0,29 | 0,19 |
| Distanza costa | 0,94 | 1 | 0,19 | 0,92 | 0,48 | -0,4 | 0,95 | 0,18 | 0,11 |
| Peyssonnelia | 0,34 | 0,19 | 1 | 0,09 | 0,45 | 0,02 | 0,32 | 0,54 | 0,54 |
| Corallinales | 0,82 | 0,92 | 0,09 | 1 | 0,35 | -0,28 | 0,85 | 0,01 | 0,01 |
| Turf | 0,61 | 0,48 | 0,45 | 0,35 | 1 | -0,25 | 0,61 | 0,64 | 0,74 |
| Erette | -0,51 | -0,4 | 0,02 | -0,28 | -0,25 | 1 | -0,39 | 0,36 | 0,29 |
| Copertura totale | 0,91 | 0,95 | 0,32 | 0,85 | 0,61 | -0,39 | 1 | 0,24 | 0,17 |
| Indice Pielou | 0,29 | 0,18 | 0,54 | 0,01 | 0,64 | 0,36 | 0,24 | 1 | 0,85 |
| Indice Shannon | 0,19 | 0,11 | 0,54 | 0,01 | 0,74 | 0,29 | 0,17 | 0,85 | 1 |
La cluster analisys, applicata ai dati di ricoprimento dei gruppi funzionali, alla similarità del 70%, individua chiaramente due principali gruppi di affioramen-ti, D e E (Figura 2). Il gruppo E include gli affioramenti più al largo, tra 10 e 28 km dalla costa (LASTRE, CERNIOTTA e ABATE), mentre il gruppo D include quelli posti a distanza intermedia, tra la costa e il mare aperto (5,8-15 km, MOTTA, PICCO, PANETTON, PIAVE, PIVETTA, TARTARUGA). I ri-manenti tre affioramenti (LA1-003, MA1-003 e CAORLE), pur essendo distinti tra loro (gruppi A, B e C) e dagli altri gruppi (D e E), hanno la caratteristica di trovarsi vicini alla costa (1-3 km) e relativamente distanti geograficamente fra loro (LA1-003, MA1-003 di fronte alla laguna di Venezia e CAORLE di fronte alla laguna di Caorle).
In figura 1, per ciascun raggruppamento, sono riportati i valori medi degli indi-catori copertura totale (%), degli indici di Pielou e Shannon e le categorie fun-zionali che caratterizzano il raggruppamento rilevate con la procedura Simper.
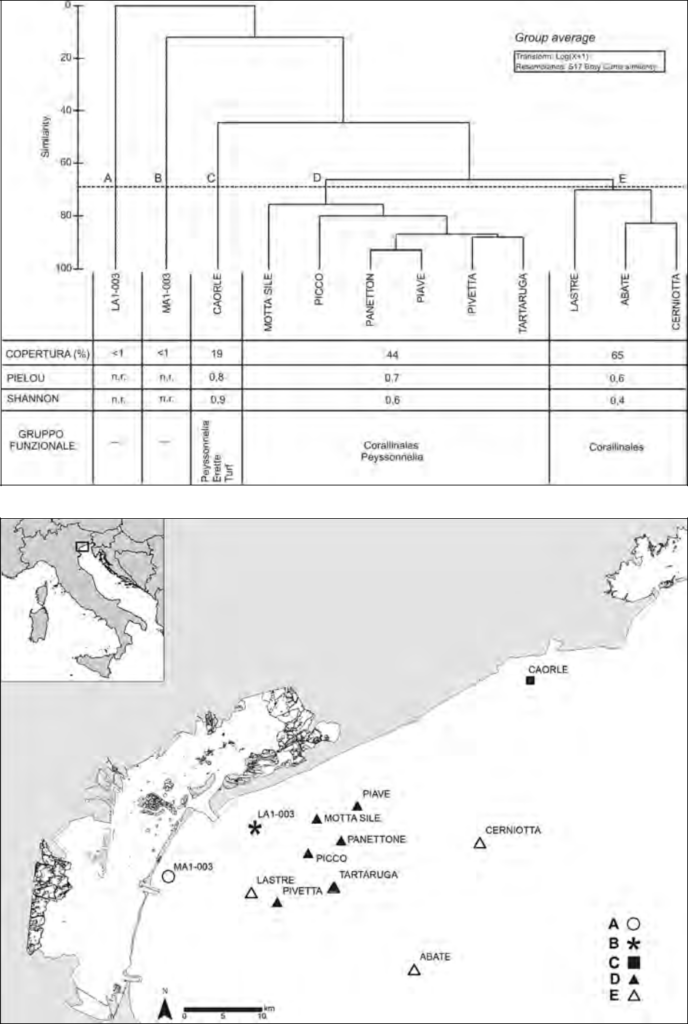
Per la vicinanza alla costa (da 1 a 3 km) peraltro di fronte alla laguna di Venezia, la comunità macroalgale negli affioramenti LA1-003 e MA1-003 risulta limitata per tutte le categorie funzionali, tanto che alcuni indicatori di riferimento (Shannon e Pielou) non possono essere calcolati o risultano nulli per l’assenza di ricoprimento effettivo. L’affioramento CAORLE (gruppo C), riconducibile alla tipologia degli affioramenti sotto costa (circa 3 km), segna un incremento della copertura algale sui substrati (media 19%) e si caratterizza per una parzia-le abbondanza di alghe incrostanti della categoria funzionale “Peyssonnelia”; l’abbondanza relativa di alghe turf ed erette indica ancora un significativo in-flusso costiero (Curiel et al., 1999; Falace, 2000; Falace et al., 2010). La vici-nanza alla costa e la contenuta profondità (10-15 m) rendono questi tre affiora-menti particolarmente esposti alla torbidità e alla risospensione dei sedimenti da eventi meteo marini, con conseguenti effetti anche di parziale seppellimento dei talli. Per l’affioramento CAORLE vanno considerati anche gli effetti nega-tivi dei flussi provenienti dalla foce del fiume Tagliamento che possono indurre sedimentazione e torbidità.
Gli affioramenti del gruppo D, posti a distanza intermedia dalla costa (5,8-15 km), segnano un sensibile incremento della copertura algale media (44%), co-stituita quasi esclusivamente dalle due categorie funzionali incrostanti, le “Co-rallinales” e “Peyssonnelia”. L’abbondanza di queste tipologie algali di “pregio ambientale”, che comprendono i generi Lithophyllum, Lithothamnion e Peys-sonnelia (Ballesteros, 2006), attribuisce a questi habitat buone condizioni eco-logiche. La maggiore distanza dalla costa rispetto agli affioramenti dei gruppi A, B e C e la profondità di 15-21 m, attenuano gli effetti della torbidità e della risospensione dei sedimenti.
Negli affioramenti del raggruppamento E, situati lontano dalla costa (10-28 km) e profondi (19-27 m), il grado di copertura totale è in media del 65%, con un ricoprimento marcato soprattutto dalle “Corallinales” (e.g. Lithophyllum, Lithothamnion), note in letteratura per essere le più sensibili agli stress. Puressendo presenti specie macroalgali di elevato livello ecologico, in questo rag-gruppamento la diversità espressa dagli indici non è elevata perché risentono dell’abbondanza della sola categoria funzionale delle “Corallinales” (“Coralli-nales” e turf per l’affioramento ABATE).
Va rilevato come i valori medi della copertura rimarchino un incremento dalla costa verso il largo; gli indici Pielou e Shannon, invece, presentano un anda-mento medio opposto, tendendo a diminuire dalla costa verso il largo.
Confronto con campionamenti distruttivi e considerazioni conclusive
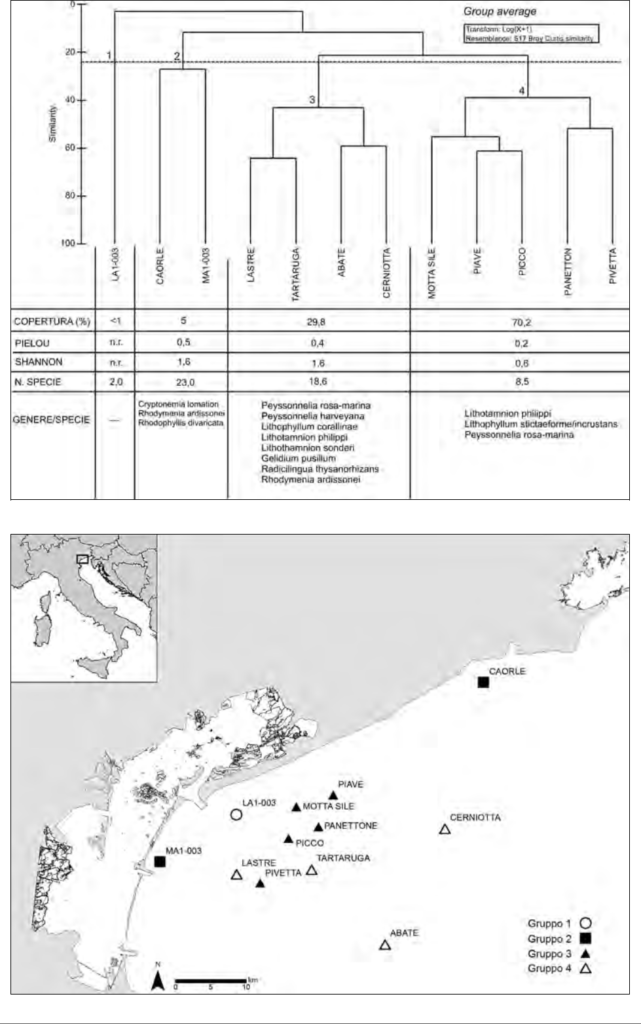
Il confronto tra i risultati del presente lavoro, basato su una metodologia di indagine fotografica non distruttiva, con quelli relativi al campionamento di-struttivo (Curiel et al., 2014) relativo ai medesimi siti (tre repliche di 50 x 50 cm2 e analisi al microscopio delle macroalghe), evidenzia un’elevata similarità e coerenza nella ripartizione degli affioramenti e nell’andamento degli indicatori (Figura 2). Ambedue le cluster analysis confermano lo schema di aggregazione dei gruppi di affioramenti secondo il gradiente costa-largo, con la sola variazio-ne dell’affioramento TARTARUGA, che cambia di raggruppamento in ragione della sua posizione geografica “intermedia”. Con la metodica di rilievo foto-grafico, infatti, tale sito risulta il più al largo tra gli affioramenti del gruppo D (Figura 1), mentre, per la metodica distruttiva, appare tra i più vicini alla costa tra quelli del gruppo 4 (Figura 2).
I tre affioramenti sotto costa (LA1-003, MA1-003 e CAORLE) confermano la loro diversità rispetto agli altri, mostrando però una maggiore affinità nel cam-pionamento distruttivo.
Anche le analisi degli indicatori di copertura totale (%), degli indici di Pielou e di Shannon e delle categorie funzionali sono in accordo con le valutazioni della metodica di rilievo non distruttiva. Si confermano in crescita, dalla costa al largo, i valori di copertura totale (da <1 a 70,2%). Sono in parziale riduzio-ne, invece, quelli degli indici di Pielou (da 0,3-0,5 sotto costa a 0,2 al largo) e di Shannon (da 1,6 sotto costa a 0,6 al largo), che risentono della marcata abbondanza delle alghe incrostanti e della diminuzione del numero di specie (da 23 a 8, verso il mare aperto). Per ambedue le metodiche, l’andamento dei due indici è da ricondurre alla progressiva lontananza dalla costa e alla maggiore profondità, con una cascata di forzanti che si possono generare, quali l’isola-mento geografico, la mancanza di corridoi ecologici che favoriscano gli scambi, il diminuito reclutamento di forme giovanili (più abbondanti sotto costa) e la minore radiazione luminosa.
Nelle figure 1 e 2, sono rappresentati anche spazialmente i raggruppamenti della Cluster Analysis e i principali descrittori medi per le due metodiche.
In letteratura, i lavori che hanno valutato l’accuratezza e l’efficienza delle metodiche di campionamento hanno concluso come ognuna presenti potenziali errori di stima e solo la loro integrazione permetta di raggiungere risultati com-pleti (Roberts et al., 1998; Moysés et al., 2007; Pech et al., 2004). In tabella 3 è riportata una sintesi, elaborata da Bianchi et al., (2003), dei vantaggi e svantaggi del prelievo diretto distruttivo e del rilievo fotografico.
Tab. 3. Confronto tra i principali metodi di campionamento subacqueo su substrati duri, in cui vengono evidenziati i principali vantaggi/ svantaggi ed impieghi (da Bianchi et al., 2003, modificato).
| Campionamento con prelievo diretto | |
| Vantaggi | Tassonomia accurata. Valutazioni obiettive dei principali parametri (n. individui, ricoprimento, ecc.). Collezione di riferimento. |
| Svantaggi | Lentezza e laboriosità delle fasi operative. Personale tecnico qualificato. Area di campionamento limitata. Impatto sull’ecosistema. Elevato impegno economico. |
| Impiego | Studi approfonditi con importante base sistematica. |
| Campionamento Fotografico | |
| Vantaggi | Valutazioni obiettive dei principali parametri. Ripetibilità. Collezione fotografica di riferimento. Possibilità di automazione e rapidità in immersione. Ampia area analizzata. Impatto ecologico nullo. Costo economico contenuto. |
| Svantaggi | Tassonomia non precisa. Impossibilità di rilevare gli organismi di piccola taglia. Difficoltà di lettura ed interpretazione dell’immagine a posteriori. |
| Impiego | Studi ciclici, monitoraggi prolungati. Lavori a profondità elevate. |
Nello specifico degli affioramenti rocciosi del nord Adriatico, un esaustivo campionamento distruttivo comporterebbe, da parte degli operatori subacquei, l’impiego di diverse attrezzature: scalpello, martello, sorbona, pompa ad acqua, una manichetta di circa 30 m, palloni di sollevamento. A profondità oltre i 20-30 m, si presentano le prime complicazioni, in primis le tempistiche ristrette dell’immersione e gli aspetti di sicurezza per gli operatori. Già a quote superiori a 30 m, il campionamento tipico di base (3 repliche ognuna di 2500 cm2) non sarebbe più portato a termine nel corso di una sola immersione da due opera-tori, ma ne richiederebbe una seconda coppia. Inoltre, l’elevata variabilità della comunità bentonica che caratterizza questi siti (Curiel et al., in stampa; Falace et al., 2015;Ponti et al., 2014) necessita, al fine di un’indagine esaustiva, di 3-10repliche per sito (AA.VV., 2010).
A fronte di una precisione tassonomica minore, un campionamento fotografico risulta operativamente più pratico e rapido e permette l’esame di un elevato numero di repliche (30-50 scatti fotografici) distribuite su una superficie più estesa dell’affioramento, includendo anche condizioni più specifiche (es. su-perfici inclinate, verticali, cavità). Inoltre, con la riduzione dei tempi di immer-sione, è possibile l’esame di un maggior numero di affioramenti nel corso della medesima uscita in mare. Durante l’analisi delle immagini importanti sono poi le informazioni aggiuntive rilevate in immersione dal secondo operatore, quali, ad esempio, la copertura generale, le macroalghe e gli organismi animali domi-nanti, i rapporti di abbondanza delle alghe incrostanti rispetto alla comunità complessiva.
Per una maggiore coerenza e confrontabilità dei dati anche a livello statistico, in accordo con altri lavori di natura ecologica sulle macroalghe dei substrati duri, queste ultime sono state ripartite in categorie funzionali (turf, erette e incrostanti, distinguendo le incrostanti in “Corallinales” e “Peyssonelia”), dopo un’analisi complessiva e coerente di tutte le immagini. Tale distinzione rispec-chia anche una diversa valenza ecologica, medio-elevata per le alghe “Peysson-nelia” (parzialmente calcificate) ed elevata per le “Corallinales” incrostanti in-teramente calcificate (Hong, 1980; Sartoretto, 1996).
Con la metodica fotografica (Foster et al., 1991; Ponti et al., 2014; Airoldi, 2003), la determinazione tassonomica, se non coadiuvata anche dal prelievo diretto di alcuni campioni, dalla presenza di esemplari di laboratorio per con-fronti o da un’elevata esperienza degli operatori a video terminale, è fortemente limitata e può arrivare, solo in pochi casi, sino a livello di specie o di genere (e.g. le alghe verdi Pseudochlorodesmis furcellata e Ulva, l’alga bruna Dyctiota, le alghe rosse Peyssonnelia, Halymenia, Botryocladia botryoides, Rhodymenia ardissonei, Gracilaria/Gracilariopsis). Se non ricondotte a categorie funzionali,si determinerebbe una gamma di livelli tassonomici troppo disomogeneo per una successiva analisi dei dati (esempi da letteratura: Coralline crust., genere Corallinales juv., green film, red crust, brown crust., Gelidium, Porphyta, Cryp-tonemia, ecc.) (Foster et al., 1991;Murray,2002).
Per comprendere l’elevata cripticità della componente algale nell’analisi delle immagini fotografiche, la medesima metodica applicata alla comunità zooben-tonica ha permesso il riconoscimento di 30-40 organismi a livello di genere o specie, identificando così oltre l’80-90% degli organismi presenti (Regione del
Veneto-Magistrato alle Acque di Venezia-Thetis-SELC, 2012; Regione del Veneto-cnr-ismar, 2014).
In sintesi, per la rapidità, ripetibilità e livello dell’informazione in grado di forni-re, la metodica fotografica ben si adatta ai monitoraggi che seguono le variazioni nel tempo delle comunità biologiche. Essa risulta particolarmente funzionale nelle indagini marine a maggior profondità,dove la tempistica dell’esecuzione, i costi operativi e la sicurezza degli operatori subacquei sono fattori determinanti. Il rilievo fotografico trova una valida applicazione nei monitoraggi di sorveglianza, da alternare a scadenze periodiche con campionamenti distruttivi, più accurati ma costosi. Il confronto tra le due metodiche ha evidenziato come, in quella fotografica, l’analisi per categorie funzionali algali, pur operando su dati con un livello tassonomico superiore al genere o alla specie, fornisca ugualmente un quadro complessivo simile in relazione ai macrogradienti.
Ringraziamenti
Si ringrazia il Ministero delle Infrastrutture e dei Trasporti – Magistrato alle Acque di Venezia (ora Provveditorato Interregionale alle OO. PP. del Veneto – Trentino Alto Adige – Friuli Venezia Giulia) tramite il Concessionario Consorzio Venezia Nuova per aver concesso l’utilizzo dei dati dello studio Op. 499 –“Intervento di valorizzazione delle aree costiere prospicienti le bocche di porto della Laguna di Venezia. Creazione di zone di tutela biologica e marina in accordo con la Re-gione del Veneto. Monitoraggio delle caratteristiche ambientali e morfologiche delle tegnùe naturali collocate nei diversi ambiti di intervento in prossimità delle bocche di porto”.
Bibliografia
Aa.Vv. (2010) – Le tegnùe dell’Alto Adriatico: valorizzazione della risorsa marina attra-verso lo studio di aree di pregio ambientale. ARPAV, 203 pp.
Airoldi L. (2003) – The effects of sedimentation on rocky coast assemblages. Oceanogr. Mar. Biol. Annu. Rev.,41: 161-236.
Ballesteros E. (2006) – Mediterranean coralligenous assemblages: A synthesis of present knowledge. Oceanogr. Mar. Biol. Annu. Rev., 44: 23-195.
Bianchi C. N., Pronzato R., Cattaneo-Vietti R., Benedetti-CecchiL., Morri C., Pansini M., Chemello R., Milazzo M., Fraschetti S., Terlizzi A., Peirano A., Salvati E., Benzoni F., Calcinai B., Cerrano C., Bavestrello G. (2003) – Hard bottoms. In: Gambi M.C., Dappiano M. (eds) Mediterranean marine benthos: a manual of methods for its sampling and study. Società Italiana di Biologia Marina, Genova, pp. 185-216.
Bianchi C.N., Cattaneo-Vietti R., Morri C., Navone A., Panzalis P., Orrù P. (2007) – Coralligenous formations in the Marine Protected Area of Tavolara Punta Coda Cavallo (NE Sardinia, Italy). Biol. Mar. Medit., 14 (2): 148-149.
Bianchi C.N, Morri. C., Navone A. (2010) – The biological assemblages of submerged rocky reefs in the Marine Protected Area of Tavolara Punta Coda Cavallo (north-east Sardinia, Italy). Sci. Rep. Port-Cros Natl. Park, 24: 39-85.
Boudouresque C.F. (1971) – Méthodes d’étude qualitative et quantitative du benthos (en particulier du phytobenthos). Téthys, 3(1): 79-104.
Caressa S., Gordini E., Marocco R., Tunis G. (2001) – Caratteri geomorfologici degli affioramenti rocciosi del Golfo di Trieste (Adriatico settentrionale). Gortania, Atti Museo Friul. di Storia Nat.,23: 5-29.
Casellato S., Stefanon S. (2008) – Coralligenous habitat in the northern Adriatic Sea:
an overview. Mar. Ecol., 29: 321-341.
Clarke K.R., Warwick R.M. (1995) – PRIMER User Manual. Plymouth Marine Labora-tory, Plymouth, UK, 151 pp.
Curiel D., Bellemo G., Marzocchi M., Iuri M., Scattolin M. (1999) – Benthic marine algae of the inlets of the lagoon of Venice (Northern Adriatic Sea – Italy) concerning environmental conditions. Acta Adriatica, 40: 111-121.
Curiel D., Orel G., Marzocchi M. (2001) – Prime indagini sui popolamenti algali degli affioramenti rocciosi del Nord Adriatico. Boll. Soc. Adriat. Sci., 80: 3-16.
Curiel D., Molin E. (2010) – Comunità fitobentoniche di substrato solido. In: AA.VV., Le tegnùe dell’Alto Adriatico: valorizzazione della risorsa marina attraverso lo studio di aree di pregio ambientale. ARPAV: 62-79.
Curiel D., Falace A., Vinko B., Kaleb S., Solidoro C., Ballesteros E. (2012) – Species composition and spatial variability of macroalgal assemblages on biogenic reefs in the northern Adriatic. Sea. Bot. Mar., 55(6): 625-638.
Curiel D., Miotti C., Checchin E., Rismondo A, Cerasuolo C., Kaleb S., Falace A. (2014) – Biodiversità macroalgale e gradienti ecologici degli affioramenti rocciosi del litorale veneto. Boll. Mus. St. Nat. Venezia, 65: 5-21.
Curiel D., Miotti C., Checchin E., Rismondo A., Kaleb S., Falace A. (in stampa) – Patterns of diversity of macroalgal assemblages on biogenic outcrops in the northern Adriatic Sea. Boll. Mus. St. Nat. Venezia.
Diaz-Pulido G., McCook L. (2008) – Macroalgae (Seaweeds). In: Chin, A. (Ed.), The State of the Great Barrier Reef. Online, Great Barrier Reef Marine Park Authority, Townsville .http://www.gbrmpa.gov.au/corp_site/info_services/publications/sotr/ downloads/SORR_Macroalgae.pdf.
Falace A. (2000) – Variazioni fisionomiche spazio-temporali della vegetazione sommersa del Golfo di Trieste: Analisi delle principali influenze ambientali. Ph.D. Dissertation, University of Trieste, Italy, 202 pp.
Falace A., Kaleb S., Poloniato D. (2010) – Macrofitobenthos. In: (E. Gordini and S. Ciriaco, eds.), Trezze o “Grebeni”: Biotopi e geotopi dell’Alto Adriatico. ArtGroup, Trieste. pp. 55-60.
Falace A., Kaleb S., Curiel D., Miotti C., Galli G., Querin S., Ballesteros E., Solidoro
C., Bandelj V. (2015) – Calcareous Bio-Concretions in the Northern Adriatic Sea: Habitat Types, Environmental Factors that Influence Habitat Distributions, and Pre-dictive Modeling. PLoS ONE 10 (11): e0140931. doi:10.1371/journal.pone.0140931.
Foster M.S., Harrold C., Hardin D.D. (1991) – Point vs. photo quadrat estimates of the cover of sessile marine organisms. J. Exp. Mar. Biol. Ecol., 146: 193-203.
Gabriele M., Bellot A., Gallotti D., Brunetti R. (1999) – Sublittoral hard substrate communities of the northern Adriatic Sea. Cah. Biol. Mar., 40: 65-76.
Gatti G., Montefalcone M., Rovere A., Parravicini V., Morri C., Albertelli G., Bianchi C.N. (2012) – Seafloor integrity down the harbor waterfront: the corallige-nous shoals off Vado Ligure (NW Mediterranean). Adv. ocean. limnol., 3 (1): 51-67.
Gordini E., Marocco R., Tunis G., Ramella R. (2004) – The cemented deposits of the Trieste Gulf (Northern Adriatic Sea): areal distribution, geomorphologic characte-ristics and high resolution seismic survey. J. Quaternary Sci., 17: 555-563.
Hong J.S. (1980) – Étude faunistique d’un fond de concrétionnement de type coralligène soumis à un gradient de pollution en Méditerranée nord-occidentale (Golfe de Fos). Thèse de Doctorat. Université d’Aix-Marseille II, 258 pp.
Laborel J. (1987) – Marine biogenic constructions in the Mediterranean. Rep. Sci. Par natl. Port-Cros,13: 97-126.
Mizzan L. (1992) – Malacocenosi e faune associate in due stazioni altoadriatiche a sub-strati solidi. Boll. Mus. civ. St. Nat. Venezia, 41: 7-54.
Mizzan L. (1995) – Le “Tegnùe”. Substrati solidi naturali del litorale veneziano: Poten-zialità e prospettive. ASAP, Venezia, 46 pp.
Molin E., Gabriele M., Brunetti R. (2003) – Further news on hard substrate communi-ties of the northern Adriatic Sea with data on growth and reproduction in Polycitor adriaticus (von Drasche, 1883). Boll. Mus. civ St. Nat. Venezia,54: 19-28.
Molin E., Pessa G., Rismondo A. (2010) – Comunità macrozoobentonica di substrato solido. In: Aa.Vv., 2010. Le tegnùe dell’Alto Adriatico: valorizzazione della risorsa marina attraverso lo studio di aree di pregio ambientale. ARPAV: 52-61.
Moysés D.N., Junqueira A.D.O.R., Lavrado H.P., Silva S.H.G. (2007) – Method for monitoring intertidal communities in a steep rocky shore: a combination of digital image technology and field operational strategy. Braz. J. Oceanogr., 55(1): 19-27.
Murray S.N., Ambrose R.F., Dethier N.N. (2002) – Methods for Performing Monitoring, Impact, and Ecological Studies on Rocky Shores. MMS OCS Study 2001-070. Coastal Research Center, Marine Science Institute, University of California, Santa Barbara, California. MMS Cooperative Agreement Number 14-35-0001-30761. 217 pp.
Newton R., Stefanon A. (1975) – The ‘Tegnùe de Ciosa’ area: patch reefs in the Northern Adriatic Sea. Mar. Geol., 8: 27-33.
Olivi G. (1792) – Zoologia Adriatica. Reale Accademia Scienze Lettere e Arti, Bassano. 334 pp.
Parravicini V., Micheli F., Montefalcone M., Villa E., Morri C., Bianchi C.N. (2010) – Rapid assessment of epibenthic communities: a comparison between two sampling techniques. J. Exp. Mar. Biol. Ecol., 395: 21–29.
Pech D., Condal A.R., Bourget E., Ardisson P. (2004) – Abundance estimation of rocky shore invertebrates at small spatial scale by high-resolution digital photography and digital image analysis. J. Exp. Mar. Biol. Ecol., 299: 185-199.
Pérès J.M., Picard J. (1964) – Nouveau manuel de bionomie benthique de la mer Médi-terranée. Rec. Trav. Stat. Mar. Endoume, 31: 1-131.
Pielou E.C. (1966) – The measurement of diversity in different types of biological col-lections. Jour. Theor. Biol., 13: 131-144.
Ponti M., Mescalchin P. (2008) – Meraviglie sommerse delle “Tegnùe”. Guida alla sco-perta degli organismi marini. Associazione “Tegnùe di Chioggia” – onlus. Editrice La Mandragora, Imola, 424 pp.
Ponti M., Fava F., Abbiati M. (2011) – Spatio-temporal variability of epibenthic assembla-ges on subtidal biogenic reefs in the northern Adriatic Sea. Mar. Biol., 158: 1447-1459.
Ponti M., Falace A., Rindi F., Fava F., Kaleb S., Abbiati M. (2014) – Beta diversity patterns in Northern Adriatic coralligenous outcrops. In: Proceedings of the second Mediterranean Symposyum on the conservation of coralligenous and other bio-construction, RAC-SPA UNEP, 2014, pp. 145-152.
Regione Del Veneto-Magistrato Alle Acque (ora Provveditorato Interregiona-le alle OO. PP. del Veneto – Trentino Alto Adige – Friuli Venezia Giulia) –
Thetis-SELC (2012) – Intervento di valorizzazione delle aree costiere prospicienti le bocche di porto della laguna di Venezia. Creazione di zone di Tutela Biologica e Marina in accordo con la Regione del Veneto. OP 499. 1. Rapporto finale delle attività di ricerca in mare, 169 pp.
Regione del veneto, cnr-ismar (2014) – Attività di monitoraggio riguardanti la distri-buzione ed estensione degli habitat bentonici e pelagici. Substrati biogenici (Teg-nùe). Rapporto finale. 70 pp.
Roberts D.E., Fitzhenry S.R., Kennelly S. J. (1994) – Quantifying subtidal macroben-thic assemblages on hard substrata using a jump camera method. J. Exp. Mar. Biol. Ecol.,177: 157-170.
Roberts D.E., Smith A., Ajani P., Davis A.R. (1998) – Rapid changes in encrusting ma-rine assemblages exposed to anthropogenic point-source pollution: a ‘Beyond BACI’ approach. Mar. Ecol. Prog. Ser.163: 213-224.
Sartoretto S. (1996) – Vitesse de croissance et bioérosion des concrétionnements “co-ralligènes” de Méditerranée nord-occidentale. Rapport avec les variations Holocènes du niveau marin. Thèse Doctorat d’Écologie, Université d’Aix-Marseille, II, 194 pp. + annexes.
Shannon C.E., Weaver W. (1949) – The mathematical theory of communication. The University of Illinois Press, Urbana, 117 pp.
Stefanon A. (1967) – Formazioni rocciose del bacino dell’Alto Adriatico. Atti Ist. Ven. Sc. Lett. Arti,125: 79-85.
