Riassunto
Il presente lavoro costituisce un aggiornamento delle conoscenze sull’erpetofauna del sito ZSC e ZPS “Cave di Noale”. L’apparente scomparsa di Triturus carnifex, Lissotriton vulgaris, Rana dalmatina, Bufo bufo viene discussa alla luce dei cambiamenti ambientali e della sempre maggior presenza di specie invasive.
Abstract
Update of herpetological knowledge of the SAC/SPA Cave di Noale (Noale, Venice)
The present contribution constitutes an update to the knowledge of the herpetofauna of the “Cave di Noale” SAC and SPA area. The apparent disappearance of Triturus carnifex, Lissotriton vulgaris, Rana dalmatina, Bufo bufo is discussed in the light of environmental changes and the increasing presence of invasive species.
Introduzione
La Zona Speciale di Conservazione e Zona di Protezione Speciale IT3250017 denominata “Cave di Noale” sorge all’interno del Comune di Noale, direttamente a ridosso del centro urbano noalese e della linea ferroviaria Trento-Venezia. L’area, con una superficie approssimativa di quarantatre ettari, è costituita da tre principali bacini eutrofici stabili di circa rispettivamente 1,7; 1,9 e 7 ha di superficie, alimentati da acqua sorgiva e dal Rio Draganziolo che la attraversa (Finotto et al., 2011).
Zona in passato vocata all’agricoltura, è stata oggetto di cavatura di argilla a partire dagli anni ’50 e fino agli anni ’70 del Novecento; da allora è stata oggetto di progressivo abbandono e naturalizzazione fino al raggiungimento della situazione odierna (Scattolin, 2011).
A partire dal 1984 a seguito dell’istituzione del Comitato del WWF del Comune di Noale, è iniziato l’iter di riconoscimento del sito, ad Oasi. A partire dal 1998 è stata instituita l’Oasi di protezione Faunistica Venatoria da parte della Provincia di Venezia ed è stata stipulata tra Provincia e WWF Italia una convenzione per la gestione. Nel 2003, grazie alla ricchezza di specie animali e vegetali è stata riconosciuta come ZPS dalla Regione Veneto (Simonella, 2006; Burloni, 2009; Bano et al., 2011; Benigno, 2014).
L’attuale stato conoscitivo dell’erpetofauna locale è riconducibile a progetti di tesi (Burloni, 2009; Scattolin, 2011; Benigno, 2014; Fabbian, 2014; Gamelli, 2018) e studi faunistici di ambito erpetologico (Borgoni et al., 1993; Semenzato et al., 1998; Bonato et al., 2007; Semenzato, 2001, 2003, 2005, 2006, 2007a, 2007b; Cappelletto & Zanetti, 2003, 2004, 2005; D’Alterio & Semenzato, 2007; Semenzato & Paggiarin 2007; Bedin & Pegorer, 2010; Pegorer et al., 2011).
Essendo passati dieci anni dalla pubblicazione dall’ultimo resoconto, si è ritenuto utile aggiornare le conoscenze sullo stato dell’erpetofauna locale alla luce delle sempre maggiori pressioni antropiche dovute alla realizzazione di opere pubbliche, quali raccordi viari e lottizzazioni, in prossimità dell’Oasi, della sempre maggiore presenza di specie invasive, come Procambarus clarckii (Girard, 1852) e Trachemys scripta ssp. (Thunberg in Schoepff, 1792) e della gestione degli habitat non sempre in linea con le direttive del Ministero dell’Ambiente e del territorio (2005) soprattutto alla luce dell’assenza di un Piano di Gestione.
Materiali e metodi
Le ricerche sul campo si sono svolte da maggio a settembre 2020 e da gennaio a maggio 2021, per un totale di 25 uscite ripartite in 15 monitoraggi diurni e 10 notturni, con una cadenza media in 2 uscite per mese. Il rilievo è stato effettuato principalmente lungo un transetto circolare corrispondente all’itinerario naturalistico dell’Oasi, perimetrale ai corpi idrici principali. Ad integrazione del monitoraggio su transetto, sono stati considerati anche avvistamenti sporadici effettuati da alcuni dagli autori durante i due anni di investigazione.
Le specie sono state individuate a vista, anche con l’ausilio di binocolo e con torce elettriche nelle uscite notturne, e cercando sotto tronchi, cortecce ed altri potenziali rifugi, tramite retinate nei corpi idrici, e mediante ascolto delle vocalizzazioni riproduttive degli anfibi anuri con l’ausilio di microfono Tascam Linear PCM Recorder DR-05 Version 2 e parabola Hi Sound, diametro 33 cm, come suggerito in Stoch & Genovesi (2016). Per facilitare il contatto con i rettili, vista la scarsa quantità di rifugi agevolmente esplorabili, la maggior parte essendo coperti da rovo o altra vegetazione, nel settembre 2020 si sono posizionati dieci ripari artificiali (cfr. Stoch & Genovesi, 2016), costituiti da tettoie in lamiera (“onduline”) di 1 x 3 m, che poi sono state regolarmente controllate durante le sessioni del 2021.
Una sessione più intensiva a cadenza settimanale è stata specificatamente dedicata all’individuazione di ovature di Rana latastei nel periodo tra febbraio a metà marzo 2021.
Nel corso di ogni rilievo si sono annotate le specie riscontrate e si è provveduto a documentare età e sesso (ove possibile), condizioni e luogo del ritrovamento (tramite l’utilizzo di GPS) dei singoli individui contattati. I dati di distribuzione sono poi stati utilizzati per produrre la cartografia di riferimento mediante software QGIS versione 3.18 “Zurich”. Per verificare l’estensione delle superfici aperte a prato, e la loro evoluzione nel tempo, si è consultato l’archivio aerofotografico del software Google Earth dall’anno 2000 al 2021 e tramite la funzione “aggiungi poligono” se ne è misurata l’area (Tab. 1).
Risultati
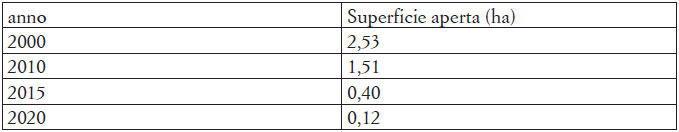
Il monitoraggio ha portato all’individuazione di tre specie di anfibi e otto di rettili (Tab. 2). Di seguito sono riportati i dati del monitoraggio 2020-2021, con l’ubicazione degli individui dei taxa contattati e i siti riproduttivi per Rana latastei.

(*)per i dati asteriscati sono accertate delle segnalazioni nel periodo intercorso tra il 2010 e il 2020, non confermate durante il monitoraggio del 2020-2021.
Amphibia
Bufonidae
Bufotes viridis (Laurenti, 1768)
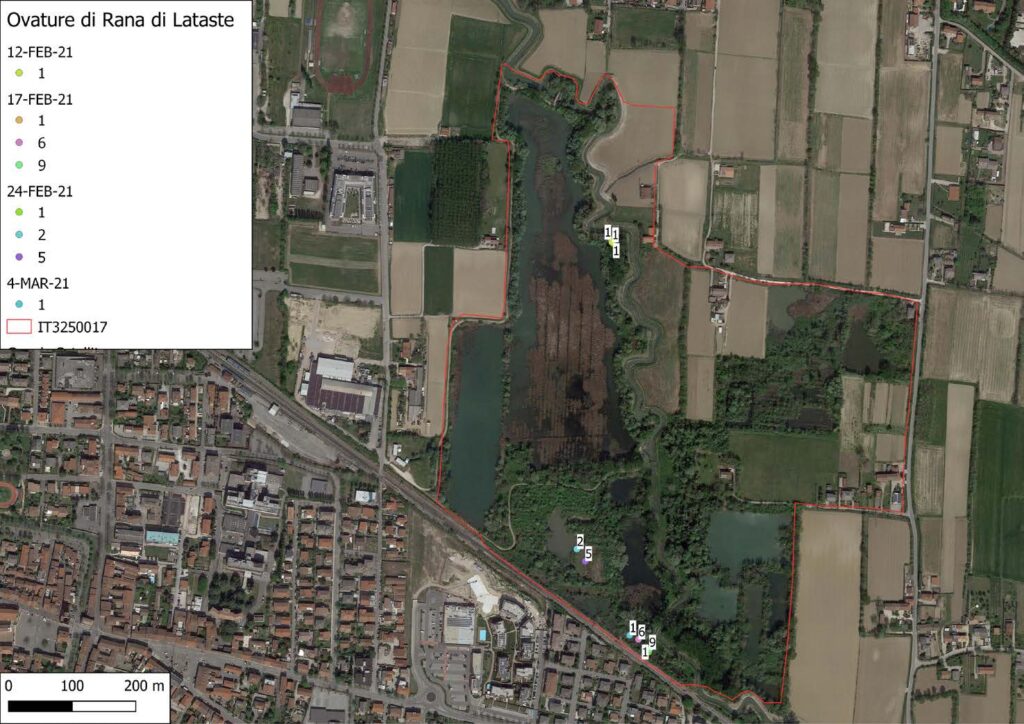
La specie è stata osservata con un totale di cinque individui, di cui un maschio adulto in canto e quattro giovani sotto un’ondulina posizionata in prossimità del parcheggio (Fig. 1).
Ranidae
Pelophylax synkl. esculentus (Linnaeus, 1758)
La specie è stata contattata con un totale di trentotto osservazioni, di cui ventuno maschi, due giovani e sedici esemplari non determinati, tutti equamente ripartiti durante il periodo di monitoraggio. Gli individui sono stati contattati in acqua durante la stagione riproduttiva o in fase di dispersione mentre attraversavano il sentiero al crepuscolo (Fig. 1).
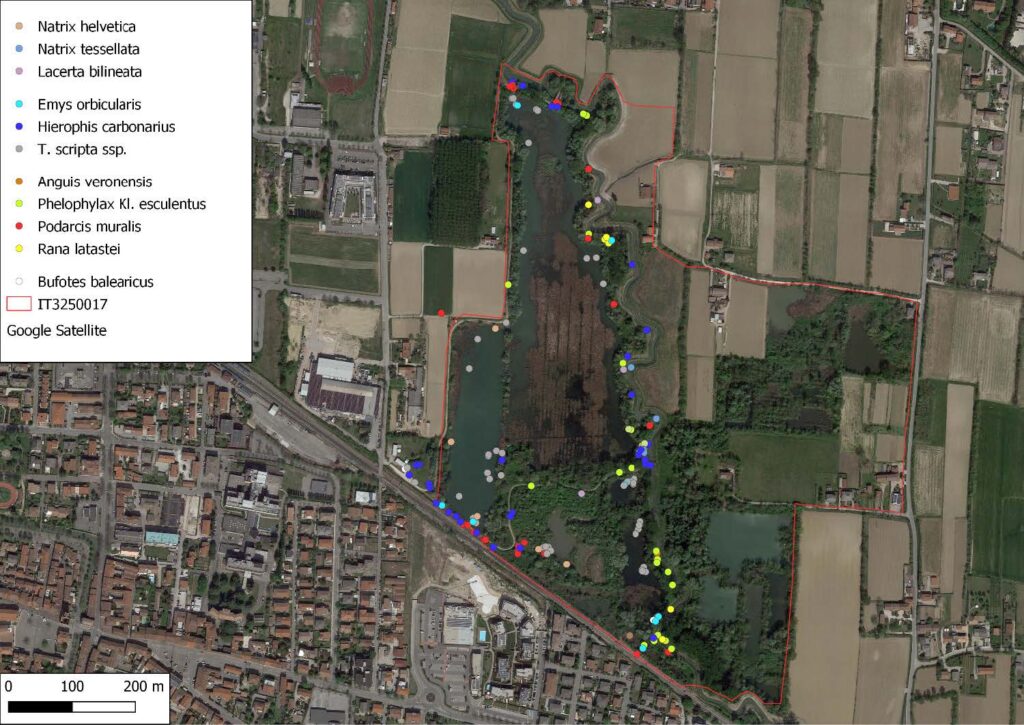
Rana latastei Boulenger, 1879
La specie (Fig. 4) è stata osservata in un totale di dieci occasioni, tre maschi, due femmine, due giovani e tre indeterminati (Fig. 1), mentre sono stati identificati al canto, nel periodo che va da inizio febbraio a metà marzo 2021, diciassette maschi (Fig. 3). Il contatto è avvenuto prevalentemente sotto copertura arborea in prossimità di pozze temporanee (Fig. 2). Sono stati inoltre individuati quattro siti riproduttivi per un totale di ventisette ovature (Fig. 2, Fig. 6). L’ovideposizione è avvenuta a partire dal 12 febbraio ed è terminata il 4 di marzo, il picco è avvenuto tra metà e fine febbraio in linea con quanto rilevato anche altrove da Bombieri et al. 2016, 2020 (Fig. 5)
Reptilia
Emydidae
Emys orbicularis (Linnaeus,1758)
La specie è stata contattata con un totale di quattordici osservazioni, equamente distribuite durante il periodo di monitoraggio, ma non è stato possibile stabilire l’età e il sesso degli individui (Fig. 1 e Fig. 7).
Trachemys scripta (Thunberg in Schoepff, 1792)
Questa testuggine risulta essere presente con le tre sottospecie T. scripta scripta (Thunberg in Schoepff, 1792), T. scripta elegans (Wied, 1839) e T. scripta troosti (Holbrook, 1836). La specie è stata osservata centoventi volte; 27 T. scripta scripta, 46 T. scripta elegans, 27 T. scripta troosti e 20 T. scripta di sottospecie indeterminata. Il taxon si è dimostrato presente e abbondante durante tutto il periodo di monitoraggio (Fig. 1 e Fig. 8).
Anguidae
Anguis veronensis Pollini, 1818
Durante tutto il monitoraggio è stata trovata solo una femmina adulta in movimento al crepuscolo, su di un argine inerbito. (Fig. 1 e Fig. 9).
Lacertidae
Podarcis muralis (Laurenti, 1768)
La specie si è dimostrata presente e relativamente abbondante durante tutto il periodo di monitoraggio, prevalentemente sui muretti in calcestruzzo perimetrali, sulle strutture in legno per pic-nic, lungo il sentiero e sul legno morto al suolo (Fig. 1). In totale sono state effettuate trentacinque osservazioni, comprendenti tredici femmine, nove maschi, dieci giovani e tre esemplari non identificati.
Lacerta bilineata Daudin, 1802
Solo durante i monitoraggi del 2021, sono stati contattati tre individui di cui due adulti ed un giovane (Fig. 1).
Colubridae
Hierophis carbonarius (Bonaparte, 1833)
Nel corso del monitoraggio la specie è stata osservata solamente in due occasioni con un esemplare adulto ed uno giovane; in entrambi i casi gli esemplari erano in caccia (Fig. 1 e Fig. 10). Inoltre, H. carbonarius è stato avvistato in ventinove occasioni, da metà aprile a metà ottobre 2020 e da marzo a maggio per l’anno 2021, spesso sotto onduline, anche nel corso di visite occasionali da parte dei coautori (RP e MB).
Natrix natrix (Linnaeus, 1758) sensu lato
La specie è stata incontrata in cinque diverse occasioni tra maggio e ottobre 2020 nel corso di diverse visite da parte di uno degli autori (RP) (Fig. 1).
Natrix tessellata (Laurenti, 1768)
Si sono osservati tre esemplari, di cui solamente uno sicuramente adulto. Tutti gli esemplari erano in fase di termoregolazione sulle pietre e sui muretti in calcestruzzo che costituiscono la struttura della chiusa (Fig. 1). La specie è stata tuttavia ritrovata in cinque altre occasioni tra Maggio ed Ottobre 2020 da parte di uno degli autori (RP) (Fig. 11).

Fig. 5. Andamento temporale delle deposizioni di Rana latastei. Come data di riferimento sono indicati il primo e l’ultimo giorno di rilievi della settimana in oggetto del 2021.
Fig. 6. Ovatura di Rana latastei.
Fig. 7. Individuo di Emys orbicularis.
Fig. 8. Diversi individui di Trachemys scripta elegans contattati durante i monitoraggi 2020 e 2021.
Fig. 9. Individuo di Anguis veronensis.
Fig. 10. Individuo di Hierophis carbonarius.
Fig. 11. Individuo di Natrix tessellata.
Discussione e conclusioni
In un territorio fortemente antropizzato e frammentato, quale è la pianura padano-veneta, aree umide e boscate costituiscono una realtà imprescindibile per la salvaguardia dell’erpetofauna autoctona. Tuttavia, la sola esistenza di habitat potenzialmente idonei non è di per sé l’unica condizione necessaria alla sopravvivenza delle diverse specie ed una attenta politica urbanistica e di gestione del territorio sono fortemente raccomandate (Hamer & McDonnell, 2008). Le differenze emerse finora, relativamente a quanto riportato da Pegorer et al. (2011), suggeriscono un generale stato di declino della biodiversità locale. Le cause di tale deperimento sono sicuramente molteplici ma almeno tre possibili fattori appaiono evidenti: la perdita di complessità del biotopo, la presenza di specie invasive e l’alta densità di Ardeidae, i quali esercitano un’importante attività predatoria a carico della comunità erpetologica (Caldonazzi et al., 2002; Agapito Ludovici et al., 2018). Basti pensare che nel corso del censimento 2020 sono stati documentati più di un centinaio di nidi tra airone guardabuoi, garzetta, airone cenerino, airone rosso e tarabusino (M. Bano pers. comm).
In riferimento agli anfibi, Rana latastei sembra essere favorita dalla presenza di piccole pozze in corrispondenza delle fasce ripariali a Populus nigra e Salix alba, a copertura colma, prive di sottobosco. Essendo queste pozze temporanee ed il periodo di ovideposizione precoce, è probabile che ovature e larve non vengano predate da Procambarus clarkii (Girard, 1852) (Vesely et al., 2015; Falaschi et al., 2020).
Di contro, la probabile scomparsa di Rana dalmatina Fitzinger in Bonaparte, 1839 è forse riconducibile alla quasi completa assenza di aree umide in zone aperte o circondate da coltivi, come indicato in Bombieri et al., 2016. Inoltre tali tipologie di ambiente sono più facilmente conquistabili da P. clarkii, specie in grado di predarne tutte le fasi di sviluppo (Falaschi et al., 2020).
La persistenza di Pelophylax synkl. esculentus è imputabile alla notevole adattabilità della specie, capace di colonizzare una grande variabilità di ambienti (Di Nicola et al., 2019).
Bufotes viridis, in quanto specie estremamente adattabile e sinantropica (Di Nicola et al., 2019), non sembrerebbe aver subito variazioni nella presenza.
Il decremento e la probabile estinzione locale di Bufo bufo (Linneus, 1758) può essere attribuibile alla frammentazione degli habitat ed al totale isolamento dell’Oasi Cave di Noale rispetto ad altre aree verdi (Petrovan & Shmidt, 2016).
L’assenza di segnalazioni recenti di Hyla perrini (Dufresnes et al., 2018) suggerisce una sostanziale riduzione della popolazione locale, probabilmente anch’essa associata all’attività predatoria di P. clarkii (Falaschi et al., 2020). Per di più l’interramento progressivo dell’habitat di transizione terra-acqua, caratterizzato da formazioni vegetali più adatte alla specie come i Caricetea, gli Juncetea e i Phragmitetea, ha favorito la massiccia presenza di rovo e caprifoglio giapponese, meno adatte, come riscontrato da Ebisuno & Gentilli (2002).
Il mancato riscontro di Triturus carnifex (Laurenti, 1768) e Lissotriton vulgaris (Linneus, 1758) è con molta probabilità da rimandarsi ad una sostanziale riduzione, se non totale scomparsa, delle popolazioni locali. Questa rarefazione potrebbe attribuirsi alla massiccia presenza di P. clarkii, specie invasiva in grado di predare tutte le fasi fenologiche delle suddette specie (Falaschi et al., 2020), agli aredeidi (Caldonazzi et al., 2002) e forse anche Trachemys sp.
Circa i rettili, Podarcis muralis è presente e molto abbondante all’interno dell’Oasi grazie alla sua capacità di colonizzare quasi ogni tipo di ambiente (Di Nicola et al., 2019). La scarsa presenza di Lacerta bilineata, peraltro non segnalata in Pegorer et al. (2011), invece è probabilmente imputabile alla sensibile riduzione delle aree a prato che attualmente risultano colonizzate da Rubus ulmifolia e Lonicera japonica, come suggerito anche da Sacchi et al. (2011). La riduzione delle aree prative è confermata dal confronto aerofotografico, indicando un rapido decremento all’interno dell’oasi dai 2,53 Ha dei primi anni 2000 agli 0,125 Ha attuali (Tab. 3).
La scarsità di osservazioni di Anguis veronensis è probabilmente dovuta alle abitudini crepuscolari della specie (Luiselli et al., 2011) e dalla difficile accessibilità da parte dei ricercatori ai rifugi.
L’apparente difficoltà nel riscontrare Natrix natrix s.l. è probabilmente associabile alla costante presenza di diverse specie di Ardeidae in grado di predare la specie in modo continuativo (Ferri & Scoccianti, 1997).
Contrariamente alla specie precedente, Natrix tessellata è più facilmente rinvenibile, in particolare in prossimità di strutture in pietra. È probabile che queste opere forniscano punti di aggregazione, in quanto all’interno dell’area studiata sono le zone più favorevoli per la termoregolazione di questa specie (Soccini & Ferri, 2000).
Hierophis carbonarius, non segnalato nel precedente studio, è risultato ben presente. Il suo arrivo è probabilmente riconducibile alla grande adattabilità della specie anche in presenza di modificazioni sensibili dell’habitat, che lo rendono adatto a colonizzare nuove aree (Di Nicola et al., 2019).
Per quanto riguarda Coronella austriaca Laurenti, 1768, l’assenza di record durante il monitoraggio è probabilmente imputabile all’elusività della specie, dovuta anche alla caratteristica “eliotermia criptica” (Fracasso in Bonato et al., 2007), infatti esistono segnalazioni sporadiche ed accidentali pregresse, soprattutto in prossimità della massicciata ferroviaria.
Emys orbicularis è ancora discretamente presente all’interno dell’oasi, tuttavia la sua possibilità di sopravvivenza è fortemente dipendente dalla presenza di aree adatte all’ovideposizione nell’oasi e dintorni e dalla potenziale competizione con Trachemys scripta sia per le fonti trofiche che per le aree di “basking” (Sartori et al., 2016). In particolare, T. scripta raggiunge la maturità sessuale più precocemente, ha un tasso riproduttivo più alto e dimensioni corporee maggiori rispetto alla controparte autoctona, dimostrando inoltre una maggiore efficienza termica, avendo una temperatura corporea ottimale più bassa rispetto ad Emys orbicularis, ed entrando quindi prima in attività. T. scripta, riconosciuta tra le specie invasive a maggior impatto sugli ecosistemi acquatici (i.e. Lindsay et al., 2013), meriterebbe un monitoraggio dedicato e possibilmente la sua inclusione in un piano di eradicazione congiunto a livello regionale (Macchi et al., 2020).
Nei limiti e nelle possibilità delle ricerche qui presentate, è emerso come nell’arco di soli dieci anni vi siano state delle variazioni nella composizione dell’erpetofauna locale, con un decremento sostanziale esclusivamente a carico della fauna anfibia. La scomparsa di specie chiave, indicatrici o dello stato di conservazione degli specchi d’acqua o del grado di complessità degli ecosistemi ripariali come sono appunto gli anfibi (Blaustein & Wake, 1995; Diamond, 1996), suggerisce che il complesso naturalistico “Oasi Cave di Noale” si stia indirizzando verso una progressiva semplificazione ecologica ed ambientale. Al fine di fermare o quanto meno limitare questo fenomeno è auspicabile, da parte degli enti gestori, l’avvio di politiche di gestione del territorio più sensibili alle reali necessità del sito, che comprendano anche la conservazione e la creazione di corridoi ecologici senza i quali le popolazioni, ormai isolate, non potranno che estinguersi.
Bibliografia
Agapito Ludovici A., Di Cerbo A. R., Ferri V., Giovine G., Manenti R., Oneto F., Rambaldi S., Valota M. (2018) – LIFE GESTIRE 2020 Nature Integrated Management to 2020. Azione A14 Piano di interventi prioritari per Salamandra atra, Triturus carnifex, Rana latastei, Pelobates fuscus insubricus, Bombina variegata ed Emys orbicularis. LIFE GESTIRE 2020 Nature Integrated Management to 2020 Azione A14: 1-160.
Bano M., Chinellato A., Cornelio P., Carraro V. (2001) – L’Oasi Cave di Noale: la bellezza della natura a due passi da casa. Grafiche Biesse, Scorzè:1-40.
Bedin L., Pegorer M. (2010) – Tritone crestato italiano, 6073. Flora e Fauna della Pianura Veneta Orientale, Osservazioni di campagna 2009. Associazione Naturalistica Sandonatese, San Donà di Piave: 54.
Benigno C. (2014) – Distribuzione e attività della testuggine alloctona Trachemys scripta in due cave rinaturalizzate della pianura veneta e problematiche di gestione e controllo delle specie aliene in siti della “Rete Natura 2000”. Tesi di laurea, Università Ca’ Foscari di Venezia, Dipartimento di Scienze Ambientali, Informatica e Statistica, Corso di Laurea Triennale in Scienze Ambientali:1-55.
Blaustein A. R., Wake D. B. (1995) – The puzzle of declining amphibian populations. Sci. Amer. 272: 52-5.
Bombieri G., Bedin L., Richard J. (2016) – Dati sulla presenza di Rana latastei e Rana dalmatina nel SIC/ZPS IT3250032 Bosco Nordio (Chioggia, VE). In: Bonato L., Trabucco R., Bon M. (a cura di), 2016. Atti 7° Convegno Faunisti Veneti. . Boll. Mus. St. Nat. Venezia, 66, suppl.: 292.
Bombieri G., Lunardi S., Pollo R., Debattisti M., Benati G., Menini F., Andrei Gabora D. A., Mazzotti S. (2020) – Stato di conservazione di una popolazione di rana di Lataste (Rana latastei). Cosa è successo dopo vent’anni dal primo monitoraggio? Quaderni del Museo Civico di Storia Naturale di Ferrara 8: 75-81.
Bonato L., Fracasso G., Pollo R., Richard J., Semenzato M. (2007) – Atlante degli Anfibi e dei Rettili del Veneto. Associazione Faunisti Veneti, Nuovadimensione Ed.
Borgoni N., Semenzato M., Richard J. (1993) – Gli Anfibi e i Rettili delle cave dismesse dell’entroterra veneziano. In: Mezzavilla F., Stival E. (red.), Atti del 1° Convegno Faunisti Veneti, C.Or.V.O., Montebelluna (TV): 39-41.
Burloni G. (2009) – Sviluppo di un percorso di interpretazione ambientale all’interno dell’oasi naturalistica “Cave di Noale”. Tesi di laurea, Università Ca’ Foscari di Venezia, Dipartimento di Scienze Ambientali, Informatica e Statistica, Corso di Laurea Triennale in Scienze Ambientali:1-51.
Caldonazzi M., Pedrini P., Zanghellini S. (2002) – Atlante degli Anfibi e dei Rettili della provincia di Trento (Amphibia, Reptilia). 1987-1996 con aggiornamenti al 2001. Studi Trentini. Sci. Nat., Acta Biol., Trento, 77: 176.
Cappelletto M., Zanetti M. (2003) – Trachemide scritta, 1408. In: Flora e Fauna della Pianura Veneta Orientale, Osservazioni di campagna 2002. Associazione Naturalistica Sandonatese, San Donà di Piave: 140.
Cappelletto M., Zanetti M. (2004) – Rospo comune, 1742. In: Flora e Fauna della Pianura Veneta Orientale, Osservazioni di campagna 2003. Associazione Naturalistica Sandonatese, San Donà di Piave: 135.
Cappelletto M., Zanetti M. (2005) – Trachemide scritta, 4168. In: Flora e Fauna della Pianura Veneta Orientale, Osservazioni di campagna 2004. Associazione Naturalistica Sandonatese, San Donà di Piave: 84.
Diamond J. M. (1996) – A Bombs against amphibians. Nature Conservation biology, 383: 386-387.
D’Alterio S., Semenzato M. (2007) – Testuggine palustre, 5083. In: Flora e Fauna della Pianura Veneta Orientale, Osservazioni di campagna 2006. Associazione Naturalistica Sandonatese, San Donà di Piave: 64.
Di Nicola M. R., Cavigioli L., Luiselli L. & Andreone F. (2019) – Anfibi & Rettili d’Italia. Ed. Belvedere, “le scienze”, Latina, 31: 568.
Ebisuno M., Gentilli A. (2002) – Reproductive site selection and characteristics of sources and sinks in an italian tree frog metapopulation (Hyla intermedia, Boulenger 1882). Rev. Écol. (Terre Vie)., 57.
Fabbian A., (2014) – Studio preliminare di comunità di Chirotteri – Oasi del WWF Cave di Noale (VE). Tesi di laurea, Università degli Studi di Padova Dipartimento di Biologia Corso di Laurea in Scienze Naturali: 1-52.
Falaschi M., Melotto A., Manenti R., Ficetola G. F. (2020) – Invasive Species and Amphibian Conservation. Herpetologica., 76: 261-227.
Ferri V., Scoccianti C. (1997) – Parco Naturale Regionale delle Groane, Comune di Lentate sul Seveso. Intervento di riqualificazione naturalistica della zona umida ex cava di argilla stagno di Lentate sul Seveso monitoraggio della situazione faunistica life96 nat/it/003068. Relazione tecnico-scientifica per l’ente di gestione: 1-13.
Finotto F., Rossetto R., Granzotto V., Corrieri R., Solati D., Zanardo M. (2011) – Valutazione Ambientale Strategica sintesi non tecnica, Comune di Salzano: 1-112.
Gamelli F., (2018) – Progettazione di un sentiero didattico sugli strigiformi all’Oasi di Cervara (TV): confronto con i principali siti naturalistici di Veneto e Friuli Venezia Giulia. Tesi di laurea Università degli Studi di Padova Dipartimento di Biologia Corso di Laurea in Scienze Naturali: 1-109.
Hamer A., Mcdonnell M. (2008) – Amphibian ecology and conservation in the urbanising world: a review. Biological Conservation., 141: 2432-2449.
Macchi S., Scali S., Bisi F., Martinoli A., Alonzi A., Carnevali L. (2020) – Piano nazionale per la gestione della testuggine palustre americana (Trachemys scripta). ISPRA, Roma: 1-30.
Lindsay M. K., Zhang Y., Forstner M. R., Hahn D. (2013) – Effects of the freshwater turtle Trachemys scripta elegans on ecosystem functioning: an approach in experimental ponds. Amphibia-Reptilia: 34(1): 75-84.
Luiselli L., Anibaldi C., Capela M. (2011) – Anguis fragilis. In: Corti, C., Capula, M., Luiselli, L., Sindaco, R., Razzetti, E. (Eds.), Fauna d’Italia: Reptilia, vol. XLV. Calderini, Bologna: 463-467.
Ministero dell’Ambiente e della Tutela del Territorio (2005) – Manuale delle linee guida per la redazione dei piani di gestione dei siti Natura 2000. Allegato 5. URL: http://www2.minambiente.it/scn/records/?section=download.
Pegorer M., Pettenò D., Semenzato M. (2011) – Nuove indagini sugli Anfibi e i Rettili dei Biotopi di Cava Senile Della Terraferma Veneziana in M. Bon, F. Mezzavilla, F. Scarton (eds.), 2011. Atti 6° Convegno Faunisti Veneti. Boll. Mus. St. Nat. Venezia, 61, suppl.: 344.
Petrovan S. O., Schmidt B. R. (2016) – Volunteer Conservation Action Data Reveals Large-Scale and Long-Term Negative Population Trends of a Widespread Amphibian, the Common Toad (Bufo bufo). PLoS ONE 11(10): 1-12.
Sartori G., Scovacricchi T., Alfarè L., Causin L., Lavazza G., Bon M., Mizzan L., Novarini N., Uliana M., Latella L., Palazzi R., Bilò F. (2016) – “Fauna aliena ed invasiva in veneto: problemi e proposte di gestione”, Veneto Tendenze 2/2016, Quaderno di documentazione del Consiglio Regionale del Veneto: 1-86.
Sacchi R., Marchesi M., Gentilli A., Pelliteri-Rosa D., Scali S., Borelli A. (2011) – Western green lizards (Lacerta bilineata) do not select the composition or structure of the ecotones in Northern Italy. North-Western Journal Of Zoology., 7 (2): 213-221.
Scattolin E.(2011) – Valutazione critica del progetto di riqualificazione dell’area “Ex cave di Noale” e ipotesi di scenari futuri. Tesi di laurea, Università IUAV di Venezia, Facoltà di Pianificazione del Territorio, Corso di laurea in Scienze della Pianificazione Urbana e Territoriale: 1-137.
Semenzato M. (2001) – Rospo comune, 473. In: Flora e Fauna della Pianura Veneta Orientale, Osservazioni di campagna 2000. Associazione Naturalistica Sandonatese, San Donà di Piave: 79.
Semenzato M. (2003) – Rospo comune, 1352, in Flora e Fauna della Pianura Veneta Orientale, Osservazioni di campagna 2002, Associazione Naturalistica Sandonatese, San Donà di Piave: 134.
Semenzato M. (2005) – Tritone crestato, 4278. In: Flora e Fauna della Pianura Veneta Orientale, Osservazioni di campagna 2004. Associazione Naturalistica Sandonatese, San Donà di Piave: 80.
Semenzato M. (2006) – Rospo comune, 4669. In: Flora e Fauna della Pianura Veneta Orientale, Osservazioni di campagna 2005. Associazione Naturalistica Sandonatese, San Donà di Piave: 62.
Semenzato M. (2007a) – Testuggine palustre, 5080, 5081. In: Flora e Fauna della Pianura Veneta Orientale, Osservazioni di campagna 2006. Associazione Naturalistica Sandonatese, San Donà di Piave: 64.
Semenzato M. (2007b) – Trachemide scritta, 4986. In: Flora e Fauna della Pianura Veneta Orientale, Osservazioni di campagna 2006. Associazione Naturalistica Sandonatese, San Donà di Piave: 64.
Semenzato M., Paggiarin L. (2007) – Colubro liscio, 5017. Flora e Fauna della Pianura Veneta Orientale, Osservazioni di campagna 2006. Associazione Naturalistica Sandonatese, San Donà di Piave: 64.
Semenzato M., Zanetti M., Ric hard J., Borgoni N. (1998) – Distribuzione storica ed attuale di Emys orbicularis e osservazioni sulla recente diffusione di Trachemys scripta nel Veneto. In: Bon M., Mezzavilla F. (red.), Atti del 2° Convegno Faunisti Veneti. Boll. Mus. civ. St. Nat. Venezia, 48, suppl.: 155-160.
Simonella I. (2006) – Atlante degli ambiti di interesse naturalistico della provincia di Venezia. Provincia di Venezia, Assessorato alle Politiche Ambientali. Cicero Editore, Venezia: 416.
Soccini C., Ferri V. (2000) – Distribuzione e note di ecologia dell’erpetofauna della sponda sinistra del lago di idro (Brescia). Natura Bresciana: Ann. Mus. Civ. Se. Nat., Brescia., 32: 105-117.
Stoch F., Genovesi P. (2016) – Manuali per il monitoraggio di specie e habitat di interesse comunitario (Direttiva 92/43/CEE) in Italia: specie animali. ISPRA, Serie Manuali e linee guida, 141/2016.
Vesely L., Buřič M., Kouba A. (2015) – Hardy exotics species in temperate zone: Can “warm water” crayfish invaders establish regardless of low temperatures? Scientific Reports: 5: 1.

